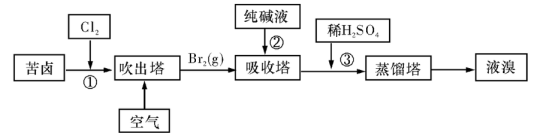
题目内容
镁及其合金是一种用途很广的金属材料,海水中镁的含量为1.10 mg·L-1,目前世界上60%的镁是从海水中提取的。主要步骤如下:
(1)为了使MgSO4完全转化为Mg(OH)2,可以加入过量试剂①,试剂①最好选用 。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是 。
(3)试剂②可以选用 ,其反应的离子方程式为 。
(4)无水MgCl2在熔融状态下,通电后会产生Cl2和Mg,写出该反应的化学方程式 。
(5)若假设海水中镁元素全部存在于MgSO4中,则海水中MgSO4的含量为 mg·L-1,若某工厂每天生产1.00 t镁,则每天需要海水的体积为 L。
(1)Ca(OH)2 (2)过滤
(3)盐酸 Mg(OH)2+2H+=Mg2++2H2O
(4)MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑
(5)5.50 9.09×108
解析

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
下列叙述正确的是
| A.金属被人类开发利用的大致年限之所以有先后,主要取决于金属在地壳中的含量多少 |
| B.海水中含有丰富的碘元素,因此碘被称为“海洋元素” |
| C.高炉炼铁的主要反应原理是碳在高温下直接将氧化铁还原成铁 |
| D.在海水中加入石灰乳可得氢氧化镁沉淀,这是从海水中富集镁的基本方法 |
已知MgO、MgCl2的熔点分别为2800℃、604℃,将MgO、MgCl2加热熔融后通电电解,都可得到金属镁。海水中含有MgCl2,工业上从海水中提取镁,正确的方法是 ( )
A.海水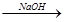 Mg(OH)2 Mg(OH)2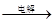 Mg Mg |
B.海水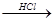 MgCl2溶液 MgCl2溶液 MgCl2熔融 MgCl2熔融 Mg Mg |
C.海水 Mg(OH)2 Mg(OH)2 MgO MgO Mg Mg |
D.海水 Mg(OH)2 Mg(OH)2 MgCl2溶液 MgCl2溶液  MgCl2熔融 MgCl2熔融 Mg Mg |
某企业以辉铜矿为原料生产碱式碳酸铜,工艺流程如下所示:
已知:[Cu(NH3)4]2+(aq)  Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
| A.气体X中含有SO2 |
| B.为实现溶液C到溶液D的转化,加NH3·H2O至红棕色沉淀刚好完全,过滤即可 |
C.蒸氨过程发生总反应的化学方程式为:[Cu(NH3)4 ]Cl2 + H2O CuO + 2HCl↑+ 4NH3↑ CuO + 2HCl↑+ 4NH3↑ |
| D.在制备产品时,溶液D中不直接加入Na2CO3溶液的原因是游离的Cu2+浓度太低 |