题目内容
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
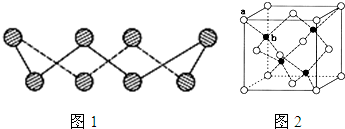
(1)S单质的常见形式是S8,其环状结构如图1所示,S原子采用的轨道杂化方式是
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为
(3)Se的原子序数为
(4)H2Se的酸性比 H2S
离子的立体构型为
(5)H2SeO3 的K1和K2分别是2.7×10-3和2.5×10-8,H2SeO4的第一步几乎完全电离,K2是1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4的第一步电离程度大于第二步电离的原因:
②H2SeO4比H2SeO3酸性强的原因:
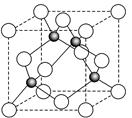
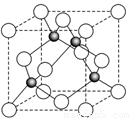
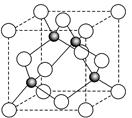
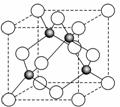
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛.立方ZnS晶体结构如图2所示,其晶胞边长为540.0pm,密度为
=4.1
=4.1g?cm-3(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为
或
或135
或
或135
pm(列式表示)

(1)S单质的常见形式是S8,其环状结构如图1所示,S原子采用的轨道杂化方式是
sp3
sp3
;(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为
O>S>Se
O>S>Se
;(3)Se的原子序数为
34
34
,其核外M层电子的排布式为3s23p63d10
3s23p63d10
;(4)H2Se的酸性比 H2S
强
强
(填“强”或“弱”).气态SeO3分子的立体构型为平面三角形
平面三角形
,| SO | 2- 3 |
三角锥形
三角锥形
;(5)H2SeO3 的K1和K2分别是2.7×10-3和2.5×10-8,H2SeO4的第一步几乎完全电离,K2是1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4的第一步电离程度大于第二步电离的原因:
第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子
第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子
;②H2SeO4比H2SeO3酸性强的原因:
H2SeO3和H2SeO4可表示为(HO)SeO和(HO)SeO2.H2SeO3中Se为+4价,而H2SeO4中Se为+6价,正电性更高.导致Se-O-H中的O原子更向Se偏移,越易电离出H+
H2SeO3和H2SeO4可表示为(HO)SeO和(HO)SeO2.H2SeO3中Se为+4价,而H2SeO4中Se为+6价,正电性更高.导致Se-O-H中的O原子更向Se偏移,越易电离出H+
.(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛.立方ZnS晶体结构如图2所示,其晶胞边长为540.0pm,密度为
| ||
| (540.0×10-10cm)3 |
| ||
| (540.0×10-10cm)3 |
| 270.0 | ||
|
135.0×
| ||
sin
|
| 3 |
| 270.0 | ||
|
135.0×
| ||
sin
|
| 3 |
分析:(1)由S8分子结构可知,在S8分子中S原子成键电子对数为2,孤电子对数为2,即价层电子对数为4;
(2)同主族元素从上到下元素的第一电离能逐渐减小;
(3)Se位于元素周期表第四周期第ⅥA族,以此可确定原子序数,根据核外电子排布规律规律书写Se的价层电子的电子排布式;
(4)根据中心原子形成的价层电子对判断杂化类型和分子的立体构型;
(5))①酸第一步电离产生的酸根阴离子带有负电荷,由于异种电荷相互吸引,第一步产生的H+抑制第二步电离;
②H2SeO3的分子结构为 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为 ,Se为+6价,后者Se原子吸电子能力强;
,Se为+6价,后者Se原子吸电子能力强;
(6)第一问我们常碰到,后面一问要注意四个Zn2+在体内的四个小立方体的中心,不在同一平面上,过b向上面作垂线,构成直角三角形,两边分别为
a;
a,即可求出斜边为
a(a 为晶胞边长).
(2)同主族元素从上到下元素的第一电离能逐渐减小;
(3)Se位于元素周期表第四周期第ⅥA族,以此可确定原子序数,根据核外电子排布规律规律书写Se的价层电子的电子排布式;
(4)根据中心原子形成的价层电子对判断杂化类型和分子的立体构型;
(5))①酸第一步电离产生的酸根阴离子带有负电荷,由于异种电荷相互吸引,第一步产生的H+抑制第二步电离;
②H2SeO3的分子结构为
 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为 ,Se为+6价,后者Se原子吸电子能力强;
,Se为+6价,后者Se原子吸电子能力强;(6)第一问我们常碰到,后面一问要注意四个Zn2+在体内的四个小立方体的中心,不在同一平面上,过b向上面作垂线,构成直角三角形,两边分别为
| ||
| 4 |
| 1 |
| 4 |
| ||
| 4 |
解答:解:(1)由S8分子结构可知,在S8分子中S原子成键电子对数为2,孤电子对数为2,即价层电子对数为4,因此S原子采用的杂化轨道方式为sp3,故答案为:sp3;
(2)同主族元素从上到下元素的第一电离能逐渐减小,则有O>S>Se,故答案为:O>S>Se;
(3)Se位于元素周期表第四周期第ⅥA族,原子序数为34,其核外电子排布式为1s22s22p63s23p63d104s24p4,则核外M层电子的排布式为3s23p63d10,
故答案为:34;3s23p63d10;
(4)同主族元素对应的氢化物中,元素的非金属性越强,对应的氢化物的酸性越弱,则H2Se的酸性比H2S强,
气态SeO3分子中Se形成3个δ键,没有孤电子对,为平面三角形分子,SO32-中S形成3个δ键,孤电子对数为
=1,则为三角锥形,
故答案为:强;平面三角形;三角锥形;
(5)①酸第一步电离产生的酸根阴离子带有负电荷,吸引H+,同时产生的H+抑制第二步电离,所以H2SeO4和H2SeO3第一步电离程度大于第二部电离程度,导致第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子,
故答案为:第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子;
②H2SeO3的分子结构为 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为 ,Se为+6价,后者Se原子吸电子能力强,导致Se-O-H中的O原子更向Se偏移,则羟基上氢原子更容易电离出H+,
,Se为+6价,后者Se原子吸电子能力强,导致Se-O-H中的O原子更向Se偏移,则羟基上氢原子更容易电离出H+,
故答案为:H2SeO3和H2SeO4可表示为 (HO)SeO和 (HO)SeO2.H2SeO3中Se为+4价,而H2SeO4中Se为+6价,正电性更高.导致Se-O-H中的O原子更向Se偏移,越易电离出H+;
(6)晶胞中含有S离子位于顶点和面心,共含有8×
+6×
=4,Zn离子位于体心,共4个,则晶胞中平均含有4个ZnS,质量为
,晶胞的体积为(540.0×10-10cm)3,则密度为
=4.1g?cm-3,
四个Zn2+在体内的四个小立方体的中心,不在同一平面上,过b向上面作垂线,构成直角三角形,两边分别为
a;
a,即可求出斜边为
a(a 为晶胞边长),则a位置S2-离子与b位置Zn2+离子之间的距离为
×540.0pm=135
pm或
或
,
故答案为:
=4.1;
或
或135
(2)同主族元素从上到下元素的第一电离能逐渐减小,则有O>S>Se,故答案为:O>S>Se;
(3)Se位于元素周期表第四周期第ⅥA族,原子序数为34,其核外电子排布式为1s22s22p63s23p63d104s24p4,则核外M层电子的排布式为3s23p63d10,
故答案为:34;3s23p63d10;
(4)同主族元素对应的氢化物中,元素的非金属性越强,对应的氢化物的酸性越弱,则H2Se的酸性比H2S强,
气态SeO3分子中Se形成3个δ键,没有孤电子对,为平面三角形分子,SO32-中S形成3个δ键,孤电子对数为
| 6+2-2×3 |
| 2 |
故答案为:强;平面三角形;三角锥形;
(5)①酸第一步电离产生的酸根阴离子带有负电荷,吸引H+,同时产生的H+抑制第二步电离,所以H2SeO4和H2SeO3第一步电离程度大于第二部电离程度,导致第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子,
故答案为:第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子;
②H2SeO3的分子结构为
 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为 ,Se为+6价,后者Se原子吸电子能力强,导致Se-O-H中的O原子更向Se偏移,则羟基上氢原子更容易电离出H+,
,Se为+6价,后者Se原子吸电子能力强,导致Se-O-H中的O原子更向Se偏移,则羟基上氢原子更容易电离出H+,故答案为:H2SeO3和H2SeO4可表示为 (HO)SeO和 (HO)SeO2.H2SeO3中Se为+4价,而H2SeO4中Se为+6价,正电性更高.导致Se-O-H中的O原子更向Se偏移,越易电离出H+;
(6)晶胞中含有S离子位于顶点和面心,共含有8×
| 1 |
| 8 |
| 1 |
| 2 |
| 4×(65+32)g/mol |
| 6.02×1023/mol |
| ||
| (540.0×10-10cm)3 |
四个Zn2+在体内的四个小立方体的中心,不在同一平面上,过b向上面作垂线,构成直角三角形,两边分别为
| ||
| 4 |
| 1 |
| 4 |
| ||
| 4 |
| ||
| 4 |
| 3 |
| 270.0 | ||
|
135.0×
| ||
sin
|
故答案为:
| ||
| (540.0×10-10cm)3 |
| 270.0 | ||
|
135.0×
| ||
sin
|
| 3 |
点评:本题综合考查物质结构与性质相关知识,涉及杂化轨道、第一电离能、电负性、电子排布式、分子的立体构型、晶胞的计算等,难度较大,需要学生具有扎实的基础与灵活运用的能力.

练习册系列答案
相关题目