题目内容
(12分)ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)氧元素能形成繁多的氧化物,请写出一个与CO2等电子的化合物 。
(2)把Na2O、 SiO2、P2O5三种氧化物按熔沸点由高到低顺序排列 。
(3)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为 ;
(4)Se原子基态核外电子的排布式为 ;H2Se的沸点:-41.1℃,H2S的沸点:-60.4℃引起两者沸点差异的主要原因是 ;
(5)SO32-离子中硫原子的杂化方式 ,该离子的立体构型为 ;
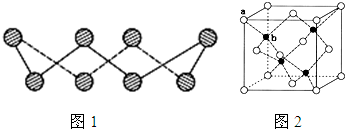
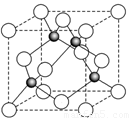
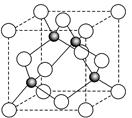
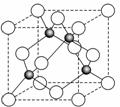
(6)某金属元素A的氧化物用作玻璃、瓷器的颜料、脱硫剂。其立方晶体的晶胞结构如右图所示,则该氧化物的化学式为 。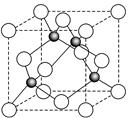
21.(12分)
(1)CS2或N2O (2)SiO2>Na2O>P2O5 (3) O>S>Se
(4) [Ar]3d104s24p4 H2Se分子之间的作用力强于H2S
(5) sp3;三角锥形 (6) AO (每小题2分)
解析试题分析:1、CO2含有22个电子,与其等电子的化合物有CS2或N2O
2、Na2O、 SiO2、P2O5三种氧化物分别为离子晶体、原子晶体、分子晶体,所以其熔沸点应是SiO2>Na2O>P2O5
3、O、S、Se原子半径逐渐增大,所以原子核对核外电子的吸引力逐渐减小,第一电离能由大到小的顺序为O>S>Se
4、Se为34号原子,原子基态核外电子的排布式为[Ar]3d104s24p4,由于H2Se分子之间的作用力强于H2S,所以才出现这种情况。
5、SO32-离子中硫原子的杂化方式sp3;该离子的立体构型为三角锥形
6图中白色小球有4个,灰色小球也有4个,所以该氧化物的化学式为AO
考点:化合物熔沸点的比较、原子核外电子的排布,晶胞的结构分析
点评:本题所考查的知识点较多,但本题所考查的知识皆为基础性知识,所以难度不大,关键点在于晶胞结构的分析,原子核外电子排布式的书写,平时应多积累和加强这方面的训练。

 阅读快车系列答案
阅读快车系列答案