题目内容
A.ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)氧元素能形成繁多的氧化物,请写出一个与CO2等电子的化合物 ▲ 。
(2)Se原子基态核外电子的排布式为 ▲ ; O、S、Se原子的第一电离能由大到小的顺序为 ▲ ;
(3)SO32-离子中硫原子的杂化方式 ▲ ,该离子的立体构型为 ▲ ;
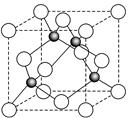
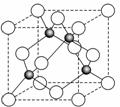
(4)某金属元素(以A表示)的氧化物用作玻璃、瓷器的颜料、脱硫剂。其立方晶体的晶胞结构如右图所示,则该氧化物的化学式为 ▲ 。
(1)CS2 或N2O
(2) [Ar]3d104s24p4 O>S>Se
(3) sp3;三角锥形
(4)AO

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目