题目内容
【题目】(1)试管Ⅰ和Ⅱ中分别加入3 mL稀盐酸(均足量),再将装0.3 g NaHCO 3和0.3 g Na2CO3粉末的小气球分别套在试管Ⅰ和Ⅱ的管口。将气球内的 NaHCO3和Na2CO3同时倒入试管中,请回答下列问题:

①试管Ⅰ中发生反应的离子方程式为________。
②加入固体后,试管_______(填 “Ⅰ”或“Ⅱ”)上的气球膨胀较快。
(2)为研究Na2CO3、NaHCO3与盐酸的反应是吸热反应还是放热反应,某同学继续进行了下列实验(每次实验各做3次平行实验,取平均值):
序号 | 35 mL试剂 | 固体 | 混合前温度/℃ | 混合后温度/℃ |
① | 水 | 2.5 g NaHCO3 | 20.0 | 18.5 |
② | 水 | 3.2 g Na2CO3 | 20.0 | 24.3 |
③ | 盐酸 | 2.5 g NaHCO3 | 20.0 | 16.2 |
④ | 盐酸 | 3.2 g Na2CO3 | 20.0 | 25.1 |
①设计1、2组实验的目的是:_______。
②通过上述实验可得出:NaHCO3溶液和盐酸的反应是_____反应,对应的图像为______。
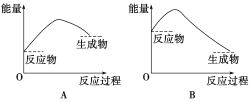
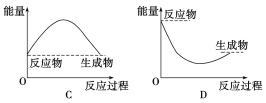
【答案】HCO3-+H+===CO2↑+H2O Ⅰ 1,2为对照组,排除物质溶解而造成的热量变化 吸热 A
【解析】
(1)①碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳;
②NaHCO3和Na2CO3与盐酸反应在同一条件下的速率不同,碳酸氢钠反应速率更快;
(2)①反应前温度相同,改变酸及固体的量,探究反应中的热效应;②由实验①、③中温度变化判断碳酸氢钠与盐酸反应的能量变化。
(1)①试管Ⅰ中碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,离子方程式为:HCO3-+H+═CO2↑+H2O,故答案为:HCO3-+H+═CO2↑+H2O;
②在同一条件下,碳酸钠与酸反应的速率小于碳酸氢钠,试管Ⅰ中碳酸氢钠与盐酸反应生成二氧化碳的速率快于试管ⅡNa2CO3与盐酸反应生成二氧化碳的速率,则试管Ⅰ气球膨胀较快,故答案是:Ⅰ;
(2)①由题给数据可知,1、2组为Na2CO3、NaHCO3溶于水的实验,溶于水前后有温度变化,所以设计1、2组实验的目的是作为实验对照组,排除Na2CO3、NaHCO3与盐酸的反应时,Na2CO3、NaHCO3溶解而造成的热量变化,故答案为:1、2为对照组,排除物质溶解而造成的热量变化;
②由实验①、③可知,当NaHCO3与盐酸反应后,混合溶液的温度降低,说明碳酸氢钠与盐酸的反应为吸热反应,反应物的总能量小于生成物的总能量,所以A符合,故答案为:吸热;A。