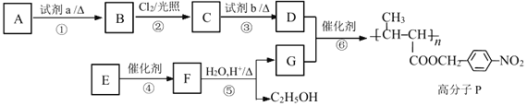
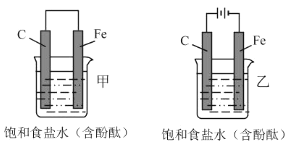
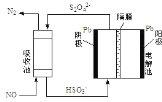
��Ŀ����
����Ŀ���״���һ�ֿ�������Դ�����й㷺��Ӧ��ǰ������ҵ�ϲ����������ַ�Ӧ�ϳɼ״���
��ӦI��CO(g)��2H2(g)![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��ӦII��CO2(g)��3H2(g)![]() CH3OH(g) + H2O(g) ��H2
CH3OH(g) + H2O(g) ��H2
��1���±����������Ƿ�ӦI�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
�¶� | 250�� | 300�� | 350�� |
K | 2.04 | 0.25 | 0.012 |
���ɱ��������жϦ�H1 _________0 �����������������������
��ij�¶��£���2 mol CO��6 mol H2����2 L���ܱ������У�5 min��ﵽƽ�⣬���c(CO)��0.2 mol��L������H2��ʾ��5min�ڸ÷�Ӧ�ķ�Ӧ����v(H2)=_______mol��L-1��min-1�����¶��´˷�Ӧ��ƽ�ⳣ��Ϊ___________����ʱ���¶�Ϊ________�����ϱ���ѡ��
��2��һ�������£���1 mol CO�� 3 mol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״����������ݻ����䣬���д�ʩ�����COת���ʵ���________��
A�������¶� B����CH3OH��g������ϵ�з���
C�����������³���He D���ٳ��������� H2
��3��Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ������������ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��С�
ʵ���� | �¶ȣ��棩 | n(CO)/n(H2) | ѹǿ��MPa�� |
1 | a | 1/2 | 0.2 |
2 | 200 | b | 5 |
3 | 350 | 1/2 | 0.2 |
A�����ϱ���ʣ���ʵ���������ݣ�a=________��b=_______��
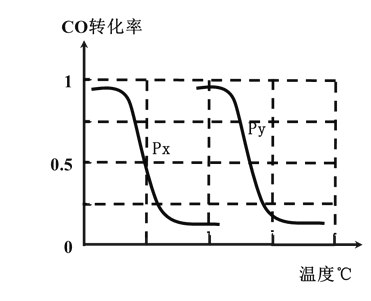
B�����ݷ�ӦI���ص㣬����ͼ����ѹǿ�ֱ�Ϊ0.2MPa��5MPa��CO��ת�������¶ȱ仯������ͼ����ָ��ͼ�е�ѹǿPy=______MPa��
��4��������Ӧ����Ҫ�õ�H2����Ӧ��Լ���Ϊԭ����ȡ�����dz��õ����ⷽ������֪��
��CH4(g) + H2O(g) = CO(g) + 3H2(g) ��H = +206.2 kJ��mol-1
��CH4(g) + CO2(g) = 2CO(g) + 2H2(g) ��H = +247.4 kJ��mol-1
��CH4��H2O(g)��Ӧ����CO2��H2���Ȼ�ѧ����ʽΪ��__________________________��
���𰸡�< 0.32 2.04 250�� BD 200 1/2 5 CH4(g) + 2H2O(g) = CO2(g) + 4H2(g) ��H = +165 kJ��mol-1
��������
��1�����ɱ������ݿ�֪���¶�Խ��ƽ�ⳣ��ԽС��˵�������¶�ƽ�����淴Ӧ�����ƶ�������ӦΪ���ȷ�Ӧ��
�ڸ���![]() ���м��㣻����
���м��㣻����![]() ����ƽ�ⳣ����
����ƽ�ⳣ����
��2�������ݻ����䣬����COת���ʣ�ƽ��������Ӧ�ƶ����������������ƽ���Ӱ�������
��3��A. ��ȡ���Ʊ�������̽���ϳɼ״����¶Ⱥ�ѹǿ�������������ݴ��ж�a��b��ֵ��
B. ���ݶ�һ���ԭ���¶�ͬ���ٱȽ�ѹǿ��������ֱx��ĸ����ߣ��Ƚ�ƽ��ʱCO��ת���ʣ��ɴ��жϡ�
��4�����ݸ�˹���ɼ��㣻
���ɱ������ݿ�֪���¶�Խ��ƽ�ⳣ��ԽС��˵�������¶�ƽ�����淴Ӧ�����ƶ�������ӦΪ���ȷ�Ӧ������H1��0��
�ʴ�Ϊ��<��
�ڳ�ʼCO��Ũ��Ϊ2mol/2L=1mol/L��![]() ��
��
![]() ��ƽ�ⳣ��
��ƽ�ⳣ��![]() ��������ʽ��
��������ʽ��

![]() ��ƽ�ⳣ��ֻ���¶��йأ��¶���ͬƽ�ⳣ����ͬ���Աȱ������ݿ�֪��ʱ�¶�Ϊ250����
��ƽ�ⳣ��ֻ���¶��йأ��¶���ͬƽ�ⳣ����ͬ���Աȱ������ݿ�֪��ʱ�¶�Ϊ250����
�ʴ�Ϊ��0.32��2.04��250����
��2����A���÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ȷ����ƶ��������淴Ӧ�����ƶ����״��IJ��ʽ��ͣ���A����
B����CH3OH��g������ϵ�з��룬�����Ũ�Ƚ��ͣ�ƽ��������Ӧ�ƶ����״��IJ������ӣ���B����
C������He��ʹ��ϵ��ѹǿ���������ݻ����䣬��Ӧ���������Ũ�Ȳ��䣬ƽ�ⲻ�ƶ����״��IJ��ʲ��䣬��C����
D���ٳ���molH2��ƽ��������Ӧ�����ƶ����״��IJ������ӣ���D��ȷ��
�ʴ�Ϊ��BD��
��3��A����ȡ���Ʊ�������̽���ϳɼ״����¶Ⱥ�ѹǿ�����������������¶ȡ�ѹǿ�DZ仯�ģ�n(CO)/n(H2)Ӧ���ֲ��䣬����b=1/2���Ƚ�ʹ��1��2��ѹǿ��ͬ�������¶�Ӧ��ͬ����a=200��
�ʴ�Ϊ��200��1/2��
B���¶���ͬʱ������ֱx��ĸ����ߣ�����ѹǿΪPy��CO��ת���ʸߣ���ӦΪǰ�������С�ķ�Ӧ��ѹǿ����ƽ���������С�ķ����ƶ�����������Ӧ�ƶ�������Px��Py������ѹǿPx=5MPa��
�ʴ�Ϊ��5��
��4����CH4��g��+H2O��g��=CO��g��+3H2��g����H=+206.2kJmol-1
��CH4��g��+CO2��g��=2CO��g��+2H2��g����H=+247.4kJmol-1
���ݸ�˹���ɼ��㣬����2-����CH4��H2O��g����Ӧ����CO2��H2���Ȼ�ѧ����ʽΪCH4��g��+2H2O��g��=CO2��g��+4H2��g����H=+165.0kJmol-1��
�ʴ�Ϊ��CH4��g��+2H2O��g��=CO2��g��+4H2��g����H=+165.0kJmol-1��