题目内容
【题目】下列说法正确的是( )
A.3C(s)+CaO(s)![]() CaC2(s)+CO(g) 在常温下不能自发进行,说明该反应的△H>0
CaC2(s)+CO(g) 在常温下不能自发进行,说明该反应的△H>0
B.寻找高效催化剂,使水分解产生氢气,同时释放能量
C.恒温恒压的密闭容器中进行反应:N2(g)+3H2(g)![]() 2NH3(g) △H=﹣aKJ/mol,平衡时向容器中再充入一定量的 NH3,重新达到平衡时 a 值减小
2NH3(g) △H=﹣aKJ/mol,平衡时向容器中再充入一定量的 NH3,重新达到平衡时 a 值减小
D.C(g)+H2O(g)![]() CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大,逆反应速率减小,平衡正向移动
CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大,逆反应速率减小,平衡正向移动
【答案】A
【解析】
A. 3C(s)+CaO(s)![]() CaC2(s)+CO(g) △S>0,在常温下不能自发进行,由G=H-TS,可得出该反应的△H>0,A正确;
CaC2(s)+CO(g) △S>0,在常温下不能自发进行,由G=H-TS,可得出该反应的△H>0,A正确;
B.催化剂只能加快反应速率,缩短反应到达平衡的时间,但不能改变反应的热焓变,水分解产生氢气,仍然吸收热量,B错误;
C. 恒温恒压的密闭容器中进行反应:N2(g)+3H2(g)![]() 2NH3(g) △H=﹣a kJ/mol,平衡时向容器中再充入一定量的 NH3,虽然平衡发生移动,但不改变a 值,C错误;
2NH3(g) △H=﹣a kJ/mol,平衡时向容器中再充入一定量的 NH3,虽然平衡发生移动,但不改变a 值,C错误;
D. C(g)+H2O(g)![]() CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大,逆反应速率也应增大,D错误。
CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大,逆反应速率也应增大,D错误。
故选A。

【题目】甲醇是一种可再生能源,具有广泛的应用前景。工业上采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:CO2(g)+3H2(g)![]() CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
(1)下表所列数据是反应I在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.04 | 0.25 | 0.012 |
①由表中数据判断ΔH1 _________0 (填“>”、“=”或“<”)。
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,5 min后达到平衡,测得c(CO)=0.2 mol/L,则用H2表示的5min内该反应的反应速率v(H2)=_______mol·L-1·min-1,该温度下此反应的平衡常数为___________,此时的温度为________(从上表中选择)。
(2)一定条件下,将1 mol CO与 3 mol H2的混合气体在催化剂作用下能自发反应生成甲醇。若容器容积不变,下列措施可提高CO转化率的是________。
A.升高温度 B.将CH3OH(g)从体系中分离
C.恒容条件下充入He D.再充入适量的 H2
(3)为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 | 温度(℃) | n(CO)/n(H2) | 压强(MPa) |
1 | a | 1/2 | 0.2 |
2 | 200 | b | 5 |
3 | 350 | 1/2 | 0.2 |
A.则上表中剩余的实验条件数据:a=________、b=_______。
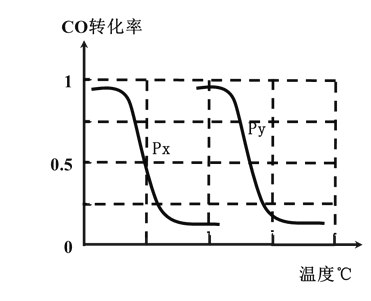
B.根据反应I的特点,左下图是在压强分别为0.2MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Py=______MPa。
(4)上述反应中需要用到H2做反应物,以甲烷为原料制取氢气是常用的制氢方法。已知:
①CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH = +206.2 kJ·mol-1
②CH4(g) + CO2(g) = 2CO(g) + 2H2(g) ΔH = +247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为:__________________________。
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:下列说法错误的是:( )
物质 | X | Y | Z |
初始浓度/ | 0.1 | 0.2 | 0 |
平衡浓度/ | 0.05 | 0.05 | 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.增压使平衡向生成Z的方向移动,平衡常数增大
【题目】用图所示装置检验乙烯时不需要除杂的是

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |