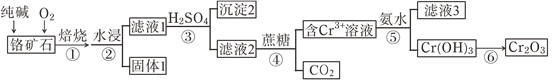
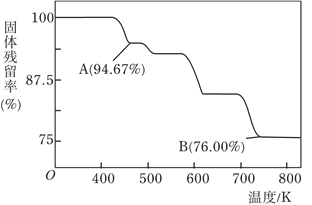
题目内容
【题目】常温下,pH=1的乙酸溶液和pH=13的NaOH溶液,下列叙述中正确的是
A. 两种溶液等体积混合后,溶液呈碱性
B. 乙酸溶液中c(CH3COOH)大于NaOH溶液中c(Na+)
C. 分别稀释10倍,两溶液的pH之和大于14
D. 若两溶液混合后pH=7,则有c(Na+)=c(CH3COO-)+c(CH3COOH)
【答案】B
【解析】
乙酸是弱电解质、氢氧化钠是强电解质,pH=1的乙酸溶液和pH=13的NaOH溶液,乙酸浓度大于氢氧化钠,两种溶液等体积混合后,乙酸有剩余,溶液呈酸性,故A错误;乙酸是弱电解质、氢氧化钠是强电解质,所以pH=1的乙酸溶液和pH=13的NaOH溶液中,乙酸浓度大于氢氧化钠,c(CH3COOH)大于NaOH溶液中c(Na+),故B正确;分别稀释10倍,乙酸的PH在1![]() 2之间、NaOH溶液的PH=12,两溶液的pH之和小于14,故C错误;若两溶液混合后pH=7,根据电荷守恒,c(Na+)=c(CH3COO-),故D错误。
2之间、NaOH溶液的PH=12,两溶液的pH之和小于14,故C错误;若两溶液混合后pH=7,根据电荷守恒,c(Na+)=c(CH3COO-),故D错误。

 名校课堂系列答案
名校课堂系列答案【题目】下列实验操作、理象和结论均正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 向某溶液中加入NaOH 溶液,并用湿润的红色石蕊试纸检验 | 试纸没有变蓝 | 原溶液中没有有NH4+ |
B | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
C | 向某溶液中滴加氯水后,再加KSCN溶液 | 溶液变红 | 原溶液中一定有Fe2+ |
D | 向某无色溶液中滴加BaCl2溶液 | 产生白色沉淀 | 该无色溶液中一定含有SO42- |
A. A B. B C. C D. D
【题目】实验室制乙烯时,产生的气体能使溴水褪色,甲、乙同学用下列实验验证。
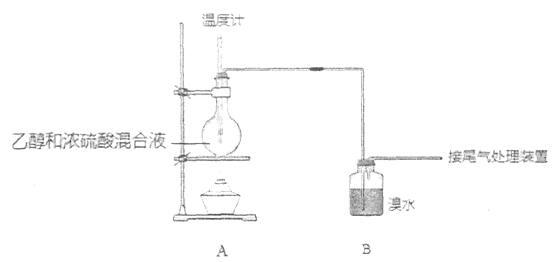
(气密性已检验,部分夹持装置略)。实验操作和现象为:
操作 | 现象 |
点燃酒精灯,加热至170℃ | I:A中烧瓶内液体渐渐变黑 II:B内气泡连续冒出,溶液逐渐褪色 |
…… | |
实验完毕,清洗烧瓶 | III:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)烧瓶内产生乙烯的化学方程式是________。
(2)溶液“渐渐变黑”,说明浓硫酸具有________性。
(3)分析使B中溶液褪色的物质,甲认为是C2H4,乙认为不能排除SO2的作用。
①根据甲的观点,使B中溶液褪色反应的化学方程式是________。
②乙根据现象III认为产生了SO2,在B中与SO2反应使溶液褪色的物质是________。
③为证实各自观点,甲、乙重新实验,设计与现象如下:
设计 | 现象 | |
甲 | 在A、B间增加一个装有某种试剂的洗气瓶 | 溴水褪色 |
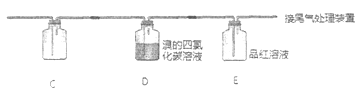
乙 | 与A连接的装置如下:
| D中溶液由红棕色变为浅红棕色时,E中溶液褪色 |
a. 根据甲的设计,洗气瓶中盛放的试剂是________。
b. 根据乙的设计,C中盛放的试剂是________。
c. 能证明确实是SO2使E中溶液褪色的实验是________。
d. 乙为进一步验证其观点,取少量D中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是________。
(4)上述实验得到的结论是________。