题目内容
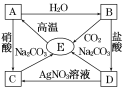
【题目】A、B、C、D、E中都含有同一种元素,它们之间的相互转化关系如图所示,其中所含的相同元素是( )
A. 铜B. 碳C. 铁D. 钙
【答案】D
【解析】
根据E高温会生成A,A和水反应生成的B和二氧化碳反应会生成A,可以猜测E是碳酸钙,A为氧化钙,B为氢氧化钙,氢氧化钙和盐酸会生成氯化钙,所以C是氯化钙;氧化钙和硝酸会生成硝酸钙,氯化钙和硝酸银会生成硝酸钙,所以D是硝酸钙,然后将推出的各种物质代入转化关系中验证即可。
E高温会生成A,A和水反应生成的B和二氧化碳反应会生成A,可以猜测E是碳酸钙,A为氧化钙,B为氢氧化钙,氢氧化钙和盐酸会生成氯化钙,所以C是氯化钙;氧化钙和硝酸会生成硝酸钙,氯化钙和硝酸银会生成硝酸钙,所以D是硝酸钙;碳酸钙在高温的条件下生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,氧化钙和硝酸反应生成硝酸钙和水,氢氧化钙和盐酸反应生成氯化钙和水,氯化钙和硝酸银反应生成硝酸钙和氯化银沉淀,氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,氯化钙和碳酸钠反应会生成碳酸钙沉淀和氯化钠,硝酸钙和碳酸钠反应生成碳酸钙沉淀和硝酸钠,推出的各种物质均满足题中的转化关系,所以A是氧化钙,B是氢氧化钙,C是氯化钙,D是硝酸钙,E是碳酸钙,其中所含的相同元素是:钙元素;
综上所述,本题选D。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊。 | 碳酸的酸性比苯酚的强 |
B | 室温下,向浓度均为0.1 mol·L–1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的氧化性比I2的强 |
D | 室温下,用pH试纸测得:0.1mol·L–1Na2SO3溶液的pH约为10;0.1mol·L–1NaHSO3溶液的pH约为5。 | HSO3–结合H+的能力比 |