��Ŀ����
����Ŀ����������������ˮ����ζ������������ˮ�㾫�����쾫�ͣ�Ҳ��������ʳƷ�У�ʵ�����Ʊ��������£�
�������������ֲ�Ʒ���Ʊ�
�ڸ����50mL����Բ����ƿ�У�����6.1g�����ᡢ������ˮ�Ҵ���8mL����1mLŨ���ᣬҡ�Ⱥ�ӷ�ʯ����װ��ˮ����ˮԡ���ȣ���ʼ���ƻ����ٶ�1��2d/s����Ӧʱ�����Ҵ���ˮ���γ�����������������������Ȼ���Լ1Сʱ������ˮ���в�����Сˮ������ʱ��ֹͣ���ȡ���Ϊ����װ�ã����������Ҵ��ͱ���
�е㣨���� | ��Է������� | |
������ | 249 | 122 |
���������� | 212.6 | 150 |
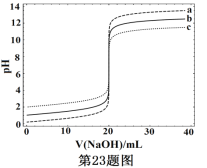
��1��д������������18O��ǵ��Ҵ�������Ӧ�ķ���ʽ___________________��
��2������A�����Ƽ���ˮͨ���_________________________��
��3��ͨ����ˮ�����Ϸ����ȥ��Ӧ���ɵ�ˮ��Ŀ����___________________��
��4��ʵ�������û�мӷ�ʯ����д�����ӷ�ʯ�IJ���___________________��
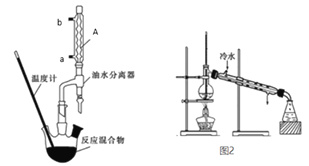
��5��ͼ2װ���еĴ���______________________��
���������������ľ���
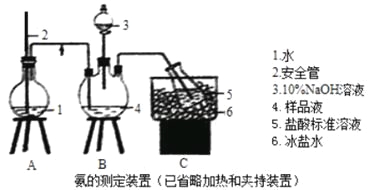
�������������ֲ�Ʒ�����·������о��ƣ�����ƿ�е�Һ�嵹��ʢ��30mL��ˮ���ձ��У������·������뱥��Na2CO3��Һ������ϸ�ķ�ĩ�����������������pH��ֽ����²���Һ�����ԡ��÷�Һ©���ֳ��ֲ��ˮ�������ѣ�10mL����ȡ���ϲ��л��࣬����ˮCaCl2��������Ĵֲ�������ˮԡ�������ѣ��ٸ��ü�ѹ�����ռ���֡�
��6�����뱥��̼������Һ���˿��Խ��ͱ����������ܽ���⣬���е�������__________��
��7�����վ�����IJ������У���ò�Ʒ���Ϊ5mL�������������ܶ�Ϊ1.05g��cm3����ʵ��IJ���Ϊ_________��
���𰸡�![]() +CH3CH218OH
+CH3CH218OH![]()
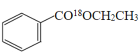 +H2O ���������ܣ�a ʹƽ�����ƣ���߱����������IJ��� ֹͣ���ȣ���Һ����ȴ�ӷ�ʯ �¶ȼ�λ�ã�����ˮ������ ��ȥ������ 70%
+H2O ���������ܣ�a ʹƽ�����ƣ���߱����������IJ��� ֹͣ���ȣ���Һ����ȴ�ӷ�ʯ �¶ȼ�λ�ã�����ˮ������ ��ȥ������ 70%
��������
��ʵ������Ϊ����������Բ����ƿ�й��ȱ����ᡢ�Ҵ�������Ũ����Ļ�����Ӧʱ�����Ҵ���ˮ���γ�����������������������Լ�װ���������ܽ���������������ˮ�����Բ��Ϸ����ˮ��ʹ��Ӧƽ�������ƶ���������ʣ�����ˮ���в�����Сˮ������ʱ��ֹͣ���ȣ�Ȼ������������Ҵ���Ȼ���������б����������ľ��ơ�
(1)�����봼����������Ӧʱ������ȥ�ǻ��������⣬���Է�Ӧ�ķ���ʽΪ![]() +CH3CH218OH
+CH3CH218OH![]()
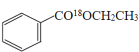 +H2O��
+H2O��
(2)��������A�Ľṹ�ص��֪��Ϊ���������ܣ�Ϊ��ǿ����Ч��Ӧa�ڽ�ˮ��b�ڳ�ˮ��
(3)������ӦΪ���淴Ӧ�����Ϸ����ˮ����ʹƽ�������ƶ�����߱����������IJ��ʣ�
(4)���ӷ�ʯ�IJ���Ϊ��ֹͣ���ȣ���Һ����ȴ�ӷ�ʯ��
(5)����ʱ�¶ȼ�ˮ��������������ƿ֧�ܿڴ���ͼʾ�¶ȼ�λ�ô�������������ˮӦ���¿ڽ���ͼʾ����ˮ�����ڴ���
(6)����̼������Һ���Ժ�δ��Ӧ�ı����ᷴӦ�����Σ��Ӷ���ȥ��Ʒ�еı����
(7)����������ʵ���Ϊ![]() =0.05mol���Ҵ����������ݷ���ʽ��֪�������ɵı���������ӦΪ0.05mol�����Բ���Ϊ
=0.05mol���Ҵ����������ݷ���ʽ��֪�������ɵı���������ӦΪ0.05mol�����Բ���Ϊ![]() =70%��
=70%��