题目内容
【题目】另一兴趣小组的同学开展了测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验。他们设计了如下的实验方案:

(1)“操作1”的名称是___________,写出反应的离子方程式______________________。
(2)滴加CaCl2溶液应“过量”,否则可能会使测定的结果________(填“偏大”或“偏小”),确定CaCl2溶液是否过量的方法是____________________________。
(3)该混合物中Na2CO3的质量分数为___________________ (保留三位小数)
【答案】过滤 ![]() 偏小 取少量溶液M,滴入适量的碳酸钠溶液,若有白色沉淀产生,则
偏小 取少量溶液M,滴入适量的碳酸钠溶液,若有白色沉淀产生,则![]() 溶液已过量 96.4%
溶液已过量 96.4%
【解析】
根据碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,过滤分离出碳酸钙,根据碳酸钙的质量求出碳酸钠的质量,进而求出该混合物中![]() 的质量分数。
的质量分数。
(1)碳酸钠溶液和氯化钙溶液反应生成碳酸钙沉淀和氯化钠,过滤可用于难溶性固体物质的分离,所以“操作1”的名称是过滤,离子方程式:![]() ,
,
故答案为:过滤;![]() ;
;
(2))加入的![]() 溶液的量不足时,得到的沉淀量会偏小,所以滴加
溶液的量不足时,得到的沉淀量会偏小,所以滴加![]() 溶液应“过量”,否则会使测定的结果偏小;氯化钙溶液能和碳酸钠反应生成碳酸钙沉淀,所以确定
溶液应“过量”,否则会使测定的结果偏小;氯化钙溶液能和碳酸钠反应生成碳酸钙沉淀,所以确定![]() 溶液是否过量的方法是取少量溶液M,滴入适量的碳酸钠溶液,若有沉淀产生,则
溶液是否过量的方法是取少量溶液M,滴入适量的碳酸钠溶液,若有沉淀产生,则![]() 溶液过量;
溶液过量;
故答案为:偏小;取少量溶液M,滴入适量的碳酸钠溶液,若有白色沉淀产生,则![]() 溶液已过量;
溶液已过量;
(3)设混合物中碳酸钠的质量为x,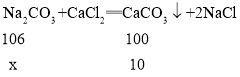 ,故
,故![]() ,解得x=10.6g,该混合物中
,解得x=10.6g,该混合物中![]() 的质量分数为:
的质量分数为:![]() ,
,
故答案为:96.4%

【题目】工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)△H
CH3OH(g)△H
(1)该反应的平衡常数表达式为_______;
(2)如表所列数据是反应在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应的△H______0(填“>”、“=”或“<”);
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10s后达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为____,用H2表示反应速率为_____,此时的温度为______;
(3)要提高CO的转化率,可以采取的措施是______;
a.升温 b.加入催化剂 c.增加CO的浓度
d.恒容充入H2 e.恒压充入惰性气体 f.分离出甲醇
【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS 等)来制备,其工艺流程如下:

回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_________________________;
(2)“溶解”时放出的气体为_______________ (填化学式);
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为______________________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式_____________;

(5)金属铬在溶液中有多种存在形式, CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应________________,根据A点数据计算出该转化反应的平衡常数为______________,温度升高,溶液中CrO42—的平衡转化率减小,则该反应的△H____0(填“>”、“<”或“=”)。
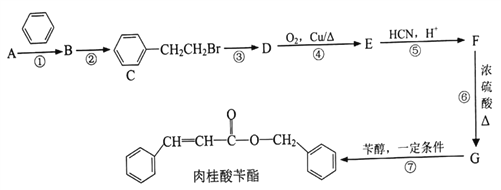
【题目】苯甲酸乙酯稍有水果气味,用于配制香水香精和人造精油,也大量用于食品中,实验室制备方法如下:
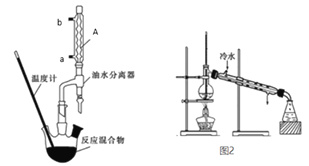
Ⅰ苯甲酸乙酯粗产品的制备
在干燥的50mL三颈圆底烧瓶中,加入6.1g苯甲酸、过量无水乙醇、8mL苯和1mL浓硫酸,摇匀后加沸石,安装分水器。水浴加热,开始控制回流速度1~2d/s。反应时苯-乙醇-水会形成“共沸物”蒸馏出来。加热回流约1小时,至分水器中不再有小水珠生成时,停止加热。改为蒸馏装置,蒸出过量乙醇和苯。
沸点(℃) | 相对分子质量 | |
苯甲酸 | 249 | 122 |
苯甲酸乙酯 | 212.6 | 150 |
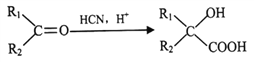
(1)写出苯甲酸与用18O标记的乙醇酯化反应的方程式___________________。
(2)仪器A的名称及冷水通入口_________________________。
(3)通过分水器不断分离除去反应生成的水,目的是___________________。
(4)实验过程中没有加沸石,请写出补加沸石的操作___________________。
(5)图2装置中的错误______________________。
Ⅱ.苯甲酸乙酯的精制
将苯甲酸乙酯粗产品用如下方法进行精制:将烧瓶中的液体倒入盛有30mL冷水的烧杯中,搅拌下分批加入饱和Na2CO3溶液(或研细的粉末),至无气体产生,pH试纸检测下层溶液呈中性。用分液漏斗分出粗产物,水层用乙醚(10mL)萃取。合并有机相,用无水CaCl2干燥。干燥后的粗产物先用水浴蒸除乙醚,再改用减压蒸馏,收集馏分。
(6)加入饱和碳酸钠溶液除了可以降低苯甲酸乙酯溶解度外,还有的作用是__________。
(7)按照纠正后的操作进行,测得产品体积为5mL(苯甲酸乙酯密度为1.05g·cm3)。实验的产率为_________。