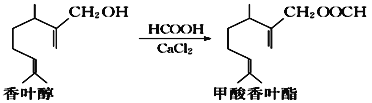
题目内容
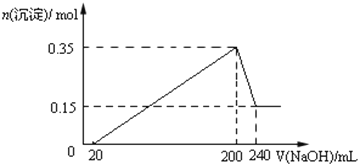
【题目】在密闭容器中的一定量混合气体发生反应:![]() 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
A.x+y﹤zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数升高
【答案】C
【解析】
保持温度不变,将容器的容积扩大到原来的两倍,A的浓度由0.50mol/L变为0.25mol/L,平衡移动后,A的浓度变为0.3mol/L,说明平衡向生成A的方向移动。
A. 对照平衡移动原理,减压,平衡向气体分子数增大的方向移动,所以x+y>z,A错误;
B. 由分析知,平衡向逆反应方向移动,B错误;
C. 平衡逆向移动,B的转化率降低,C正确;
D. 平衡逆向移动,C的体积分数减小,D错误。
答案为C。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、 Cu2 (OH)2 CO3等杂质]为原料制取二氧化锰.其工艺流程示意图如下图所示:
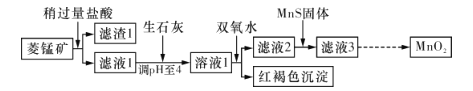
已知生成氢氧化物沉淀的pH如下表所示:
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度均为0.1mol·L—1
请回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是__________;盐酸溶解MnCO3的化学方程式是____________________________。
(2)向溶液1中加入双氧水时.发生反应的离子方程式是_________________。
(3)向滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,发生反应的离子方程式是_________________________。
(4)将MnCl2转化为MnO2的一种方法是氧化法。其具体做法是用酸化的NaClO3溶液将MnCl2氧化,请完成该反应的离子方程式:5Mn2++2ClO3—+____===____+_____+_____。
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是______________________。
②若在上述MnO2溶液中加入一定量的Mn(NO3 )2粉末.则无Cl2产生.其原因是______。