题目内容
【题目】物质的量在计算中有广泛的应用,请完成下列各小题:
(1)9gH2O与__________gH3PO4所含分子数相等。
(2)固体X在一定条件下加热分解,其方程式为2X![]() Y↑+2Z↑+2W↑,测得生成的混合气体的密度是相同状况下H2的a倍,则X的相对分子质量为__________。
Y↑+2Z↑+2W↑,测得生成的混合气体的密度是相同状况下H2的a倍,则X的相对分子质量为__________。
(3)在同温同压下,6.5g某气体A的分子数与7gC2H4的分子数相等,则气体A在标准状况下的密度为__________gL-1(结果保留三位有效数字)。
(4) b%的硫酸溶液与4b%的硫酸溶液等质量混合后,所得溶液中溶质的质量分数__________(填“>”、“<”或“=”,下同)2.5b%;如果等体积混合,所得溶液中溶质的质量分数__________2.5b%。
【答案】49 5a 1.16 = >
【解析】
(1)分子数相同,则物质的量相同,结合n=![]() 计算;
计算;
(2)相同条件下,气体的密度之比等于其摩尔质量之比,生成的混合气体对氢气的相对密度为a,则混合气体的平均摩尔质量为2ag/mol,根据质量守恒再结合M=![]() 计算X的摩尔质量,摩尔质量在数值上等于其相对分子质量;
计算X的摩尔质量,摩尔质量在数值上等于其相对分子质量;
(3)分子数相同,则物质的量相同,结合n=![]() 、ρ=
、ρ=![]() 计算;
计算;
(4)等质量混合,混合后浓度等于![]() ;硫酸的浓度越大,密度越大,硫酸的密度大于水的密度,将两个质量分数的硫酸等体积混合,则混合后的质量分数比原来两硫酸的质量分数的平均值要大,对于密度小于水的溶液,将两个质量分数的溶液等体积混合,则混合后的质量分数比原来两溶液的质量分数的平均值要小。
;硫酸的浓度越大,密度越大,硫酸的密度大于水的密度,将两个质量分数的硫酸等体积混合,则混合后的质量分数比原来两硫酸的质量分数的平均值要大,对于密度小于水的溶液,将两个质量分数的溶液等体积混合,则混合后的质量分数比原来两溶液的质量分数的平均值要小。
(1)水的物质的量为![]() =0.5mol,分子数相同,则物质的量相同,可知H3PO4的质量为:0.5mol×98g/mol=49g;
=0.5mol,分子数相同,则物质的量相同,可知H3PO4的质量为:0.5mol×98g/mol=49g;
(2)相同条件下,气体的密度之比等于其摩尔质量之比,生成的混合气体对氢气的相对密度为a,则混合气体的平均摩尔质量为2a/mol,假设有2molX反应则生成1molY、2molZ、2molW,生成物的质量=2ag/mol×(1+2+2)mol=10ag,反应前后质量不变,则X的质量为10ag,其摩尔质量=![]() =5ag/mol,摩尔质量在数值上等于其相对分子质量,所以X的相对分子质量为5a;
=5ag/mol,摩尔质量在数值上等于其相对分子质量,所以X的相对分子质量为5a;
(3)同温同压下,6.5g某气体A的分子数与7g C2H4的分子数相同,A的物质的量为![]() =0.25mol,M(A)=
=0.25mol,M(A)=![]() =26g/mol,则气体A在标准状况下的密度为
=26g/mol,则气体A在标准状况下的密度为![]() =1.16g/L;
=1.16g/L;
(4)b%的硫酸溶液与4b%的硫酸溶液等质量混合后,所得溶液的质量分数等于![]() ;硫酸的密度大于水,将两个质量分数的硫酸等体积混合,则混合后的质量分数比原来两硫酸的质量分数的平均值要大,即将b%的硫酸溶液与4b%的硫酸溶液等体积混合,所得硫酸溶液的质量分数要大于2.5b%。
;硫酸的密度大于水,将两个质量分数的硫酸等体积混合,则混合后的质量分数比原来两硫酸的质量分数的平均值要大,即将b%的硫酸溶液与4b%的硫酸溶液等体积混合,所得硫酸溶液的质量分数要大于2.5b%。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
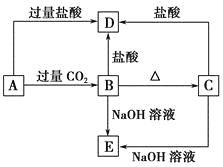
期末集结号系列答案【题目】下图是物质间发生化学反应的颜色变化,下表选项中的物质对应正确的是( )
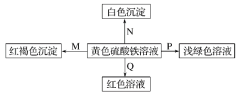
选项 | M | N | P | Q |
A | NH3·H2O | Ba(OH)2 | 铜 | 石蕊溶液 |
B | Na | BaCl2 | FeO | KSCN |
C | NaOH | Ba(NO3)2 | 锌粉 | KSCN |
D | Na2O2 | MgCl2 | Fe | 石蕊溶液 |
A.AB.BC.CD.D
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、 Cu2 (OH)2 CO3等杂质]为原料制取二氧化锰.其工艺流程示意图如下图所示:
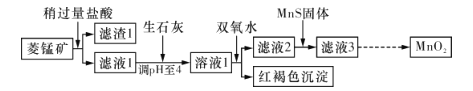
已知生成氢氧化物沉淀的pH如下表所示:
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度均为0.1mol·L—1
请回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是__________;盐酸溶解MnCO3的化学方程式是____________________________。
(2)向溶液1中加入双氧水时.发生反应的离子方程式是_________________。
(3)向滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,发生反应的离子方程式是_________________________。
(4)将MnCl2转化为MnO2的一种方法是氧化法。其具体做法是用酸化的NaClO3溶液将MnCl2氧化,请完成该反应的离子方程式:5Mn2++2ClO3—+____===____+_____+_____。
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是______________________。
②若在上述MnO2溶液中加入一定量的Mn(NO3 )2粉末.则无Cl2产生.其原因是______。