题目内容
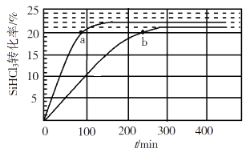
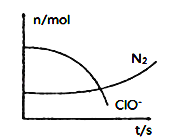
【题目】某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是( )
A.标准状况下若生成2.24LN2,则转移电子1mol
B.还原性:Cl-<CN-
C.参与反应的氧化剂与还原剂的物质的量之比为5:2
D.氧化剂是含ClO-的物质,氧化产物只有N2
【答案】D
【解析】
由曲线变化图可知,随反应进行ClO-的物质的量降低,N2的物质的量增大,故ClO-为反应物,N2是生成物,根据电子转移相等可知,CN-是反应物,由氯元素守恒可知Cl-是生成物,由碳元素守恒可知HCO3-是生成物,由氢元素守恒可知H2O是反应物.反应中Cl元素化合价由+1价降低为-1价,化合价总共降低2价,C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,化合价升降最小公倍数为2[(4-2)+(3-0)]=10价,故CN-系数为2,ClO-系数为5,由元素守恒可知HCO3-系数为2,N2系数为1,Cl-系数为5,H2O系数为1,反应方程式为2CN-+5ClO-+H2O=2HCO3-+N2↑+5Cl-,据此分析作答。
A. 2.24L N2(标准状况)的物质的量为0.1mol,所以参加反应的ClO的物质的量为0.5mol,反应中只有氯元素化合价降低,由ClO中+1价降低为Cl中1价,所以转移电子为0.5mol×2mol=1mol,A项正确;
B. 反应方程式为2CN-+5ClO-+H2O=2HCO3-+N2↑+5Cl-,还原剂为CN,还原产物为Cl-,还原剂的还原性大于还原产物的还原性,因此还原性比较:Cl-<CN-,B项正确;
C. 由上述分析可知,反应为2CN-+5ClO-+H2O=2HCO3-+N2↑+5Cl-,反应中是CN是还原剂,ClO是氧化剂,氧化剂与还原剂的化学计量数之比为5:2,C项正确;
D. 反应中,C元素化合价由CN中+2价升高为HCO3中+4价,N元素化合价由CN中3价升高为N2中0价,可知氧化产物有HCO3、N2,D项错误;
答案选D。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】下表为元素周期表的一部分,表中列出11种元素在周期表中的位置,按要求回答下列各题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑧ | ||||||
3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
4 | ② | ④ | ⑩ |
(1)这11种元素中,化学性质最不活泼的元素是______(填元素符号,下同),得电子能力最强的原子是______,失电子能力最强的单质与水反应的化学方程式__。
(2)元素④的离子结构示意图为___________。
(4)写出③的单质置换出⑥的单质的化学方程式:_____。
①和⑤两种元素最高价氧化物对应的水化物相互反应的离子方程式为________。
②的最高价氧化物对应水化物与⑤的最高价氧化物反应的化学方程式为________。