题目内容
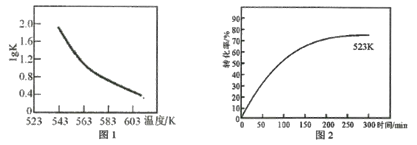
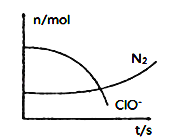
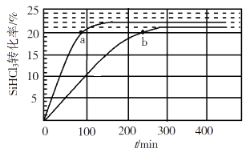
【题目】向1L恒容密闭容器中充入2mol SiHCl3,采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时发生反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH,SiHCl3的转化率随时间变化的结果如图所示。
(1)上述反应每生成1g SiH2Cl2(g)吸收1.1kJ热量,则ΔH=______________。
(2)323K时,反应的平衡转化率α=______________。
(3)343K时,前200min内,SiCl4(g)的平均反应速率为______________。
(4)比较a、b两处反应速率大小![]() _______(填“>”“<”或“=”)
_______(填“>”“<”或“=”)![]() 。
。
(5)在343K条件下,要缩短反应达到平衡的时间,并且要增大平衡时SiH2Cl2(g)的浓度,可采取的措施是______________________。
【答案】+111.1kJ/mol 21% 0.0011mol/(L·min) > 增大压强
【解析】
(1)根据物质反应的能量变化与物质的变化成正比,计算产生1mol SiH2Cl2吸收的能量,就可得到反应热;
(2)根据该反应的正反应是吸热反应,利用温度对化学平衡移动的影响,结合图像分析判断。
(3)在343K时,先计算前200min内SiHCl3的反应速率,然后根据物质反应转化关系,计算SiCl4(g)的平均反应速率;
(4)根据温度对化学反应速率的影响分析比较;
(5)根据外界条件对化学反应速率和化学平衡移动分析。
(1)生成1g SiH2Cl2(g)反应吸收1.1kJ热量,则反应产生1mol SiH2Cl2吸收热量为Q=101×1.1kJ=111.1kJ,所以该反应的热化学方程式为:2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH =+111.1kJ/mol,反应热为+111.1kJ/mol ;
(2)由于该反应的正反应是吸热反应,升高温度,平衡向吸热的正反应方向移动,反应物的转化率增大,所以曲线b是323K时的反应曲线,由图像可知此时反应物的平衡转化率为21%;
(3)根据图像可知:在343K时,前200min内SiHCl3的转化率是22%,在反应开始时加入2mol SiHCl3,容器的容积是1L,则反应速率υ(SiHCl3)= =0.0022mol/(L·min),根据方程式可知υ(SiCl4):υ(SiHCl3)=1:2,所以υ(SiCl4)= 0.0011mol/(L·min);
=0.0022mol/(L·min),根据方程式可知υ(SiCl4):υ(SiHCl3)=1:2,所以υ(SiCl4)= 0.0011mol/(L·min);
(4)a、b两点物质的转化率相同,物质的浓度相等,由于温度a>b,温度越高,反应速率越快,所以a、b两处反应速率大小:![]() >
>![]() ;
;
(5)在343K条件下,要缩短反应达到平衡的时间,反应速率就要加快,同时要增大平衡时SiH2Cl2(g)的浓度,可采取的措施是只能是增大压强。

【题目】实验室制备1,2-二溴乙烷的反应原理如下:![]()
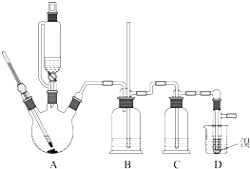
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:有关数据列表如下:
回答下列问题:
乙醇 | 1,2—二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g.cm-3- | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
【1】在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是______;(填正确选项前的字母)
a 引发反应 b 加快反应速度 c 防止乙醇挥发 d 减少副产物乙醚生成
【2】装置B的作用_____________。
【3】在装置C中应加入______,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a 水 b 浓硫酸 c 氢氧化钾溶液 d 饱和碳酸氢钠溶液
【4】判断该制备反应已经结束的最简单方法是___________;将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在______层(填“上”、“下”);
【5】若产物中有少量未反应的Br2,最好用________洗涤除去;若产物中有少量副产物乙醚,可用____的方法除去;
【6】反应过程中应用冷水冷却装置D,其主要目的是_______;
【7】但又不能过度冷却(如用冰水),其原因是_______.