题目内容
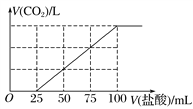
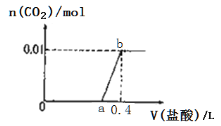
【题目】有50mL NaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液10mL将其稀释到100mL,并向此稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况下)与所加入的HCl的体积之间的关系如图所示:
甲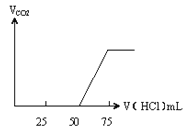 乙
乙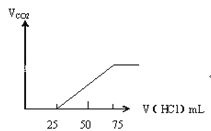
试
(1)NaOH在吸收CO2气体后,在甲、乙两种情况下,所得溶液中存在的溶质是甲:_____。
(2)乙情况下产生的CO2气体(标准状况)乙:______mL。
(3)原NaOH溶液的物质的量浓度是_____;
【答案】NaOH,Na2CO3 112mL 0.75mol/L
【解析】
当生成CO2气体时,发生反应NaHCO3+HCl=NaCl+H2O+CO2↑;
(1)(甲)中生成CO2气体至最大,消耗HCl为25mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为25mL,而图象中开始生成CO2气体时消耗HCl体积为50mL,说明该阶段还发生反应NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3;
(2)而(乙)中从25mL~75mL消耗50mL盐酸时生成的二氧化碳,根据方程式进而计算生成二氧化碳的体积;
(3)加入75mL盐酸时,溶液中溶质都恰好完全反应,此时溶液为NaCl溶液,根据守恒可知10mL溶液中n(NaOH)=n(NaCl)=n(HCl),进而计算原氢氧化钠溶液的浓度。
当生成CO2气体时,发生反应NaHCO3+HCl=NaCl+H2O+CO2↑;
(1)(甲)中生成CO2气体至最大,消耗HCl为25mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为25mL,而图象中开始生成CO2气体时消耗HCl体积为50mL,说明该阶段还发生反应NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3;
(2)(乙)中从25mL~75mL消耗50mL盐酸时生成的二氧化碳,该阶段发生的离子反应为H++HCO3-=H2O+CO2↑,则生成二氧化碳为0.05L×0.1mol/L=0.005mol,体积为0.005mol×22.4L/mol=0.112L=112mL;
(3)加入75mL盐酸时,溶液中溶质都恰好完全反应,此时溶液为NaCl溶液,根据守恒可知10mL溶液中n(NaOH)=n(NaCl)=n(HCl)=0.075L×0.1mol/L=0.0075mol,故原氢氧化钠溶液的浓度=![]() =0.75mol/L。
=0.75mol/L。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案【题目】向物质Y中逐渐加入(或通入)X溶液,生成沉淀的量与加入X的物质的量关系如图所示,下表中符合图示情况的是
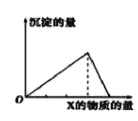
A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A.AB.BC.CD.D