题目内容
【题目】某研究性学习小组设计了用氧化浓盐酸的方法制取氯气的实验,其实验装置如图:
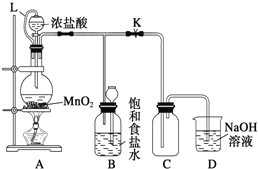
(1)写出圆底烧瓶中发生反应的化学方程式:__。
(2)如果将过量的二氧化锰与20mL12mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol。其主要的原因有①__;②__。
(3)L的作用是___;饱和食盐水的作用是__。
(4)为了提高浓盐酸的利用率,你对实验的建议是__。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 加热使HCl大量挥发 盐酸变稀后不再发生反应 平衡压强作用,便于液体顺利流下 吸收氯气中的氯化氢 小火加热
MnCl2+Cl2↑+2H2O 加热使HCl大量挥发 盐酸变稀后不再发生反应 平衡压强作用,便于液体顺利流下 吸收氯气中的氯化氢 小火加热
【解析】
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(2)二氧化锰只能与浓盐酸发生反应,与稀盐酸不反应;
(3)L将分液漏斗与圆底烧瓶连接,起到平衡压强作用;浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水;
(4)依据浓盐酸易挥发的性质解答。
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,化学方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2))如果将过量的二氧化锰与20mL12mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol的原因是浓盐酸具有挥发性,加热促进氯化氢的挥发,随着反应的进行,盐酸的浓度逐渐减小,二氧化锰只能与浓盐酸发生反应,与稀盐酸不反应,氯化氢不可能完全反应,故答案为:加热使HCl大量挥发;盐酸变稀后不再发生反应;
(3)L将分液漏斗与圆底烧瓶连接,起到平衡压强作用,便于液体顺利流下;浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以可以用饱和食盐水吸收氯气中的氯化氢,故答案为:平衡压强作用,便于液体顺利流下;吸收氯气中的氯化氢;
(4)因为浓盐酸易挥发,为了提高浓盐酸的利用率,应小火加热,故答案为:小火加热。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】下列有关实验操作、现象和结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向BaCl2溶液中通入CO2 | 产生白色沉淀 | 白色沉淀为BaCO3 |
B | 向 NaHCO3溶液中先加入CaCl2溶液,再加入NaOH溶液 | 产生白色沉淀 | 白色沉淀为CaCO3 |
C | 向某溶液加入NaOH溶液,用湿润的红色石蕊试纸检验产生的气体 | 湿润的红色石蕊试纸未变蓝 | 该溶液中一定不含有 |
D | 向某溶液中先加入HNO3溶液,再加入BaCl2溶液 | 产生白色沉淀 | 该溶液中一定含有 |
A. A B. B C. C D. D








