题目内容
下列判断正确的是
| A.根据同周期元素的第一电离能变化趋势,推出P的第一电离能比S大 |
| B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正化合价都是+7 |
| C.晶体中一定存在化学键 |
| D.正四面体分子中键角只能是109°28′ |
A
解析试题分析:A、由于P原子的最外层电子处于半充满的稳定状态,所以失去电子消耗的能量要比D大。正确。B、在卤族元素由于F原子半径小,非金属性强,所以没有正化合价。除此之外其它元素都有最高正化合价+7。错误。C、对于惰性气体来说,属于分子晶体,每个原子就是一个分子。分子内不存在化学键。所以晶体中不一定存在化学键。错误。D、在正四面体分子中只有几何中心与相邻两个原子之间的夹角才是109°28′。即键角是109°28′。若是相邻两个顶点连线的夹角,则为60°,如白磷分子的键角就是60°。错误。
考点:考查原子结构、分子结构及晶体结构的知识。

练习册系列答案
 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
下列有关周期表的叙述中正确的是
| A.碱土金属元素是指ⅡA族的所有元素 |
| B.除第一周期外,其他周期均有18种元素 |
| C.过渡元素都是副族元素 |
| D.主族元素的原子,半径越大,越容易得到电子 |
下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是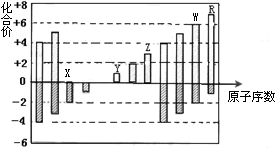
| A.原子半径:Z>Y>X |
| B.气态氢化物的还原性:W>R |
| C.WX3和水反应形成的化合物是离子化合物 |
| D.含Z的盐溶液一定显示酸性 |
在化学变化过程中,原子中的下列粒子数可能发生改变的是( )
| A.质子数 | B.中子数 | C.质量数 | D.电子数 |
短周期元素X、Y、Z的原子序数依次增大,Y为ⅠA族元素,X与Z同主族,3种元素原子的最外层电子数之和为13,下列判断正确的是( )
| A.Y元素位于第2周期 | B.Y、Z均能与X形成不只一种化合物 |
| C.X是VA族元素 | D.氢化物的稳定性:HnZ > HnX |
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子。根据以上叙述,下列说法中正确的是
| A.上述四种元素的原子半径大小为W<X<Y<Z |
| B.W、X、Y、Z原子的核外最外层电子数的总和为20 |
| C.W与Y可形成既含极性共价键又含非极性共价键的化合物 |
| D.由W与X组成的化合物的沸点总低于由W与Y祖传的化合物的沸点 |
a、b、c、d、e五种短周期主族元素,在元素周期表中的相对位置如下表。b与d可以形成两种常见的化合物,下列说法错误的是
| | | a | b | |
| c | | | d | e |
B.原子半径的大小顺序为:a>b>c>d>e
C.b元素在地壳中的含量居第一位
D.元素d的非金属性小于e
下列排列顺序不正确的是
| A.熔点:Al>K>Na | B.微粒的半径:Cl- >Na+>Mg2+>Al3+ |
| C.热稳定性:HF>HCl>HBr>HI | D.结合质子能力:AlO-2>CO32->F- |