题目内容
下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是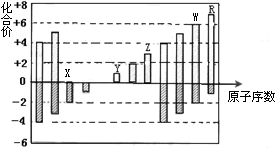
| A.原子半径:Z>Y>X |
| B.气态氢化物的还原性:W>R |
| C.WX3和水反应形成的化合物是离子化合物 |
| D.含Z的盐溶液一定显示酸性 |
B
解析试题分析:A、同周期元素原子半径随原子序数的增大而减小,属于原子半径:Y>Z>X,错误;B、同周期元素随原子序数的增大,非金属性逐渐增强,所以气态氢化物的还原性:W>R,正确;C、根据化合价和原子序数可知WX3为SO3,是共价化合物,错误;D、Z元素为Al,含Z的盐溶液可能显酸性,也可能显碱性,如Na[Al(OH)4]溶液显碱性,错误。
考点:本题考查元素周期律、元素的推断。

练习册系列答案
相关题目
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | —— |
| 最低负价 | —— | -1 | —— | —— | -3 | -2 | |
A.元素X和Q形成的化合物中不可能含有共价键
B.X、Z、R的最高价氧化物的水化物之间可两两相互反应
C.R3-比Q2-更容易失去电子
D.M(OH)2的碱性比XOH的碱性强
2012年1月,俄美科学家联合小组宣布合成出114号元素的一种同位素, 该同位素原子的质量数为298。以下叙述正确的是( )
| A.该元素属于第六周期 |
| B.该元素位于第ⅢA族 |
| C.该元素为金属元素,性质与82Pb相似 |
| D.该同位素原子含有114个电子,185个中子 |
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法正确的是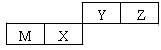
| A.原子半径Z > Y |
| B.X 的最简单气态氢化物的热稳定性比Z的小 |
| C.Y的最高价氧化物对应水化物的酸性比X 的弱 |
| D.M的最高价氧化物对应水化物不能与NaOH溶液反应 |
已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是( )
| A.原子序数:Y>X>Z>W | B.离子半径: X+>Y2+>Z->W2- |
| C.原子最外层电子数:Z>W>Y>X | D.还原性: X>Y W2-> Z- |
下列判断正确的是
| A.根据同周期元素的第一电离能变化趋势,推出P的第一电离能比S大 |
| B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正化合价都是+7 |
| C.晶体中一定存在化学键 |
| D.正四面体分子中键角只能是109°28′ |
下列说法中错误的是
| A.SO2、SO3都是极性分子 |
| B.在NH4+和[Cu(NH3)4]2+中都存在配位键 |
| C.元素电负性越大的原子,吸引电子的能力越强 |
| D.PCl3和NF3分子中所有原子的最外层都达到8电子稳定结构 |
19世纪门捷列夫的突出贡献是
| A.提出了原子学说 | B.提出了分子学说 |
| C.发现了稀有气体 | D.发现了元素周期律 |
下列说法正确的是
| A.第三周期金属元素的氧化物都属于碱性氧化物 |
| B.电子层结构相同的不同离子,其半径随核电荷数增大而减小 |
| C.IA族元素的金属性一定比IIA族元素的金属性强 |
| D.单原子形成的离子,一定与稀有气体原子的核外电子排布相同 |