题目内容
【题目】电石和水发生反应生成乙炔的化学方程式为![]() ,通过下列某些实验装置制取、净化、检验乙炔气体,并通过测定乙炔的物质的量计算电石的纯度。请回答下列问题。
,通过下列某些实验装置制取、净化、检验乙炔气体,并通过测定乙炔的物质的量计算电石的纯度。请回答下列问题。
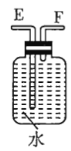
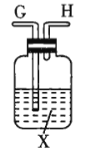
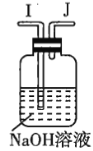
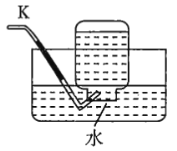
注:![]() 为
为![]() 溴的
溴的![]() 溶液,其中
溶液,其中![]() 的质量分数为3.2%。
的质量分数为3.2%。
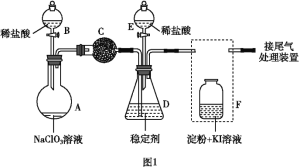
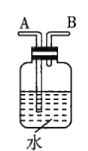
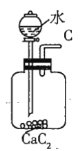
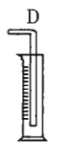
(1)若用上述仪器和导管组装实验装置,试从图中选用几种必要的装置,并把它们连成一套装置,则被选用装置的接口编号连接顺序是__________。
(2)若该实验产生的气体有难闻的臭鸡蛋气味,说明产生的气体中含有杂质______(填化学式),检验此杂质的化学反应方程式为_________。
(3)假设用![]() 的电石与水反应后,溴的
的电石与水反应后,溴的![]() 溶液中的
溶液中的![]() 恰好被完全反应,生成
恰好被完全反应,生成![]() ,测得排入量筒内液体的体积为
,测得排入量筒内液体的体积为![]() (标准状况下),则该电石纯度的计算式为_______________。
(标准状况下),则该电石纯度的计算式为_______________。
【答案】![]()
![]()
![]() (合理即可)
(合理即可) 
【解析】
(1)解答时需要考虑气体制备装置、气体净化装置、气体检验装置和排水法测气体体积的装置,据此来选择仪器;
(2)电石制乙炔时,产物中往往有杂质![]() ,这是一种难闻的有臭鸡蛋气味的气体;
,这是一种难闻的有臭鸡蛋气味的气体;
(3)首先根据题干给出的信息计算溴的物质的量,而1分子乙炔在加成时可以消耗2分子溴,因此得出乙炔的物质的量;根据![]() 不难看出乙炔和电石的物质的量之比为1:1,代入其摩尔质量来计算纯度(质量分数)即可。
不难看出乙炔和电石的物质的量之比为1:1,代入其摩尔质量来计算纯度(质量分数)即可。
(1)该实验需要的装置依次为气体制备装置、气体净化装置(除硫化氢)、气体检验装置、排水法测气体体积的装置,故所选用装置接口的连接顺序为![]() ;
;
(2)电石中含有硫化物,与水反应生成有臭鸡蛋气味的硫化氢气体,检验![]() 可以用硫酸铜溶液,会产生黑色沉淀,其化学方程式为
可以用硫酸铜溶液,会产生黑色沉淀,其化学方程式为![]() ;
;
(3)溴的![]() 溶液中的
溶液中的![]() 恰好被完全反应生成
恰好被完全反应生成![]() ,则
,则![]() 的物质的量为
的物质的量为![]() ,则消耗的乙炔的物质的量为
,则消耗的乙炔的物质的量为![]() ,测得排入量筒内液体体积为
,测得排入量筒内液体体积为![]() (标准状况下),则收集到的乙炔的体积为
(标准状况下),则收集到的乙炔的体积为![]() ,其物质的量为
,其物质的量为![]() ,所以乙炔的总物质的量为
,所以乙炔的总物质的量为![]() ,由
,由![]() 可知,
可知,![]() 的物质的量为
的物质的量为![]() ,所以该电石纯度的计算式为
,所以该电石纯度的计算式为 。
。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案【题目】元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
元素 | A | B | C | D |
性质或结构信息 | 单质制成的高压灯发出的黄光透雾力强、射程远 | 工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构 | 单质在常温、常压下是气体,原子的 | 2价阳离子的核外电子排布与氖原子相同 |
(1)A与Cl形成的化合物为__________(填“离子”或“共价”)化合物,含有__________键。
(2)D和C形成的化合物中含有__________键。写出C单质与水反应的化学方程式:____________________。
(3)下列对元素B及元素B的常见单质描述正确的是__________(填序号)。
a.B元素的最高正价为+6
b.常温、常压下B的常见单质难溶于水
c.B的常见单质分子中含有18个电子
d.在一定条件下镁条能与B的常见单质反应
(4)若B与H能形成![]() ,则B为__________元素,
,则B为__________元素,![]() 中含有的化学键为__________。
中含有的化学键为__________。
(5)A和D两元素中金属性较强的是__________(写元素符号),写出能证明该结论的一个实验事实:____________________。