题目内容
【题目】某化学实验小组用酸性KMnO4溶液与草酸(H2C2O4)溶液反应,研究外界条件对反应速率的影响,实验操作及现象如下:
编号 | 实验操作 | 实验现象 |
I | 向一支试管中先加入1 mL 0.01 mol/L酸性KMnO4溶液,再加入1滴3 mol/L硫酸和9滴蒸馏水,最后加入1 mL 0.1 mol/L草酸溶液 | 前10 min内溶液紫色无明显变化,后颜色逐渐变浅,30 min后几乎变为无色 |
II | 向另一支试管中先加入1 mL 0.01 mol/L酸性KMnO4溶液,再加入10滴3 mol/L硫酸,最后加入1 mL 0.1 mol/L草酸溶液 | 80 s内溶液紫色无明显变化,后颜色迅速变浅,约150 s后几乎变为无色 |
(1)写出高锰酸钾与草酸反应的离子方程式:______________________________。
(2)由实验I、II可得出的结论是_______________________________。
(3)关于实验II中80 s后溶液颜色迅速变浅的原因,该小组提出猜想:反应中生成的Mn2+对该反应有催化作用。利用提供的试剂设计实验III,验证猜想。提供的试剂:0.01 mol/L酸性 KMnO4溶液,0.1 mol/L草酸溶液,3 mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水补全实验III的操作:向试管中先加入1 mL 0.01 mol/L酸性KMnO4溶液,_______,最后加入1 mL 0.1 mol/L草酸溶液。
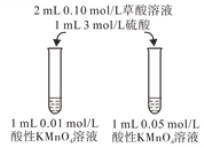
(4)该小组拟采用如图所示的实验方案继续探究KMnO4溶液浓度对反应速率的影响。你认为他们的实验方案______(填“合理”或“不合理”),理由是___________。
【答案】5H2C2O4+2MnO4-+6H+==2Mn2++10CO2↑+8H2O 其他条件相同时,H+(或硫酸)浓度越大,反应速率越快 再加入10滴3 mol/L硫酸,然后加入少量MnSO4固体 不合理 KMnO4溶液浓度不同,溶液起始颜色深浅不同,无法通过比较褪色时间长短判断反应快慢
【解析】
⑴高锰酸钾与草酸反应生成锰离子、二氧化碳、水。
⑵实验I、II其他条件相同,只是氢离子浓度不相同,氢离子浓度越大,变色所需时间越短,反应速率越快。
⑶为了验证实验II中80 s后溶液颜色迅速变浅的是否有锰离子其催化作用,应其他条件相同,只改变锰离子的量。
⑷高锰酸钾浓度不同,则高锰酸钾溶液颜色深浅不同,不能通过褪色时间长短来判断应快慢。
⑴高锰酸钾与草酸反应生成锰离子、二氧化碳、水,其离子方程式:5H2C2O4+2MnO4-+6H+ = 2Mn2++10CO2↑+8H2O;故答案为:5H2C2O4+2MnO4-+6H+ = 2Mn2++10CO2↑+8H2O。
⑵实验I、II其他条件相同,只是氢离子浓度不相同,氢离子浓度越大,变色所需时间越短,反应速率越快,因此实验I、II可得出的结论是其他条件相同时,H+(或硫酸)浓度越大,反应速率越快;故答案为:其他条件相同时,H+(或硫酸)浓度越大,反应速率越快。
⑶为了验证实验II中80 s后溶液颜色迅速变浅的是否有锰离子其催化作用,应其他条件相同,只改变锰离子的量,因此向试管中先加入1 mL 0.01 molL1酸性KMnO4溶液,再加入10滴3 molL1硫酸,然后加入少量MnSO4固体,最后加入1 mL 0.1 molL1草酸溶液;故答案为:再加入10滴3 molL1硫酸,然后加入少量MnSO4固体。
⑷由于高锰酸钾浓度不同,则高锰酸钾溶液颜色深浅不同,不能通过褪色时间长短来判断应快慢,因此他们的实验方案不合理;故答案为:不合理;KMnO4溶液浓度不同,溶液起始颜色深浅不同,无法通过比较褪色时间长短判断反应快慢。

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案