题目内容
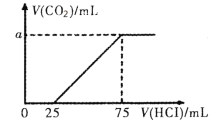
【题目】向100mL NaOH溶液中通入一定量的CO2后,在继续向该溶液中逐滴加入0.2 mol·L-1的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如下图所示
下列有关说法不正确的是
A.原溶液中NaOH的物质的量浓度为0.15 mol·L-1
B.0~25 mL发生的离子反应为:OH-+ H+ =H2O
C.通入CO2后所得的溶液中溶质的物质的量之比为1:1
D.纵坐标中a的数值为224
【答案】B
【解析】
生成CO2发生的反应为:NaHCO3+HCl=NaCl+CO2↑+H2O,假设NaOH与CO2气体反应所得溶液中只有Na2CO3,则开始阶段发生反应:Na2CO3+HCl=NaHCO3+NaCl,由方程式可知,前后两个阶段消耗盐酸的体积应相等,而实际生成二氧化碳消耗的盐酸体积多,故NaOH与CO2气体反应所得溶液中溶质为Na2CO3、NaHCO3。
A、加入100mL盐酸时二氧化碳的体积达最大,此时溶液为NaCl溶液,根据氯离子、钠离子守恒,所以n(NaOH)=n(NaCl)=n(HCl)=0.075L×0.2mol/L=0.015mol,所以c(NaOH)=![]() =0.15mol/L,故A正确;
=0.15mol/L,故A正确;
B、0~25 mL时,盐酸与Na2CO3反应生成NaHCO3,故离子方程式为:CO32﹣+H+═HCO3﹣,故B错误;
C、先发生Na2CO3+HCl=NaHCO3+NaCl,消耗25 mL盐酸,则碳酸钠的物质的量为0.025L×0.2 molL﹣1=0.005mol,生成二氧化碳发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,共消耗盐酸75mL﹣20mL=50mL,n总(NaHCO3)=n(HCl)=0.05L×0.2mol/L=0.01mol,原来溶液中碳酸氢钠为0.01﹣0.005=0.005mol,所以通入CO2后所得的溶液中溶质的物质的量之比为1:1,故C正确;
D、生成二氧化碳发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,共消耗盐酸75mL﹣20mL=50mL,n(CO2)=n(HCl)=0.05L×0.2mol/L=0.01mol,所以V(CO2)=0.01mol×22.4L/mol=0.224L=224mL,故D正确。
答案选B。