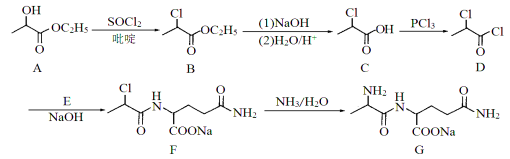
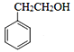
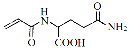��Ŀ����
����Ŀ��ij�о�С��ͬѧͨ������������ȡ������ˮ��ϡ����ĻƼ������[KNH4Fex(SO4)y(OH)z]����ͨ��ʵ��ⶨ��Ʒ�лƼ���������й���ɡ�

ʵ��ⶨ��
����ȡһ����������Ʒ����ϡ�����г���ܽ⣬��������Һת��������ƿ�����Ƴ�l00mL��ҺA��
����ȡ25.00mL��ҺA�����������ữ��BaCl2��Һ��������ȫ�����ˡ�ϴ�ӡ����������أ��õ���ɫ����9.32g��
����ȡ25.00mL��ҺA����������KI����2.000mol��L��1Na2S2O3��Һ���еζ�(��֪��ӦΪI2+2Na2S2O3�T2NaI+Na2S4O6������30.00mL Na2S2O3��Һ���յ㡣
(1)��[KNH4Fex(SO4)y(OH)z]��x��y��z�Ĵ�����ϵʽΪ ��
(2)������H2SO4��pH����Ϊ2������Һc(Fe3+)ӦΪ mol��L��1��(��֪Ksp[Fe(OH)3]��4.0��10��38)
(3)ʵ��ⶨ���м�������Ƿ���ȫ�ķ����� ��
(4)��������ʵ�����ݼ�����Ʒ�е�n(Fe3+)��n(SO42��)��(д���������)
���𰸡�(1)3x+2=2y+z (2)0.04 (3)���ã�ȡ���ɳ�������ϲ���Һ1-2ml���μ��������ữ���Ȼ�����Һ�����ް�ɫ�������ɣ��������������ȫ (4)3:2
��������
���������(1)��[KNH4Fex(SO4)y(OH)z]�У�KԪ�ػ��ϼ�+1�ۣ�NԪ�ػ��ϼ�-3�ۣ�HԪ�ػ��ϼ�+1�ۣ�SO42-���ϼ۴�����Ϊ-2�ۣ�OH-���ϼ۴�����Ϊ-1�ۣ�+1+(-3)+(+1)��4++3x+(-2y)+(-1��z)=0��x��y��z�Ĵ�����ϵʽΪ��3x+2=2y+z��
(2)������H2SO4��pH����Ϊ2��c(OH-)=![]() =10-12mol/L��Ksp[Fe(OH)3])=4.0x10-38=c(Fe3+)c3(OH-)��c(Fe3+)=
=10-12mol/L��Ksp[Fe(OH)3])=4.0x10-38=c(Fe3+)c3(OH-)��c(Fe3+)=![]() =0.04mol/L��
=0.04mol/L��
(3)ʵ��ⶨ������������Ƿ���ȫ�ķ����ǣ����ã�ȡ���ɳ�������ϲ���Һ1-2ml���μ��������ữ���Ȼ�����Һ�����ް�ɫ�������ɣ��������������ȫ��
(4)����ȡһ����������Ʒ����ϡ�����г���ܽ⣬��������Һת��������ƿ�����Ƴ�l00.00mL ��ҺA������ȡ25.00mL��ҺA�����������ữ��BaCl2��Һ��������ȫ�����ˡ�ϴ�ӡ����������أ��õ���ɫ����9.32g������ȡ25.00mL��ҺA����������KI����2.000molL-1Na2S2O3��Һ���еζ�(��֪��ӦΪI2+2Na2S2O3�T2NaI+Na2S4O6������30.00mL Na2S2O3��Һ���յ���25ml��Һ��������������ʵ��������ᱵ���ʵ�����ͬ��n(SO42-)=n(BaSO4)=![]() =0.04mol��
=0.04mol��
2Fe3+��I2��2Na2S2O3
2 1 2
n(Fe3+)=2n(I2)=n(Na2S2O3)=2.000mol/L��0.03L=0.06mol��
��Ʒ�е�n(Fe3+)��n(SO42-)=0.06mol��0.04mol=3��2��

 ȫ��������ϵ�д�
ȫ��������ϵ�д�����Ŀ�������ʽṹ�����ʡ��ѱ���Ϊ�������������������������������Ҫ�Ľṹ���ϡ�
(1)��̬��ԭ�ӵĺ�������Ų�ʽ�� ��
(2)���ʯ(TiO2)���۵�1825���������η�ֱ�ӵ����ʯ�ɻ�ý����ѣ����ʯ�����ľ��������� ���塣
(3)TiCl4����NH4Cl��Ӧ���������(NH4)2[TiCl6]��
����������У��γ���λ��ʱ�ṩ�¶Ե��ӵ��� ��(��Ԫ�ط���)
����NH4����Ϊ�ȵ������һ��������Ϊ ��(�ѧʽ)
(4)TiO2+��H2O2��ϡ���з�Ӧ�����ٺ�ɫ��[TiO(H2O2)]2+���ӣ��������ѵĶ��Լ��顣���й���H2O2��˵����ȷ���� ��(�����)
A���ռ乹��Ϊֱ���� |
B�����Ǽ��Լ��ļ��Է��� |
C��Oԭ�ӹ���ӻ�����Ϊsp3 |
D����ѧ���ʲ��ȶ�����Ϊ����ļ��ܽ�С |
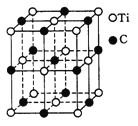
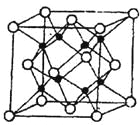
(5)�������һ������(Ti)ԭ�Ӻ�̼ԭ�ӹ��ɵ���̬�Ŵط��ӣ��ṹģ����ͼ��ʾ�����ķ���ʽΪ ��