题目内容
【题目】[化学------选修3:物质结构与性质]
M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是 ,X和Y中电负性较大的是 (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,
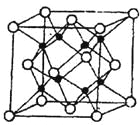
则图中黑球代表的离子是_________(填离子符号),该离子的配位数为 。该晶胞参数a="b=c=d" pm ,列式计算R2M晶体的密度为 g/cm。
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是__________。
【答案】(1)1s22s22p63s1;Cl
(2)H2O分子能形成氢键,而H2S不能形成氢键(3)平面三角形
(4)Na+;4;(4×62)÷[NA×(d×10-10)3]
(5)3H2O2+K2Cr2O7+4H2SO4=Cr2(SO4)3+3O2↑+7H2O+K2SO4
【解析】试题分析:M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子数的2倍,核外电子排布式为1s22s22p4,故M为O元素;由原子序数可知R、X、Y均处于第三周期,R是同周期元素中最活泼的金属元素,则R为Na;X和M形成的一种化合物是引起酸雨的主要大气污染物,则X为S元素,可知Y为Cl;Z的基态原子4s和3d轨道半充满,外围电子排布式为3d54s1,处于VIB族,故Z为Cr.
(1)R为Na,基态原子的电子排布式是1s22s22p63s1,同周期自左而右电负性增大,故Cl元素电负性大于S的;
(2)H2O分子能形成氢键,使水的沸点升高,而H2S不能形成氢键,故硫化氢的沸点低于水的;
(3)X与M形成的SO3分子中S原子孤电子对数=(6-2×3)÷2=0,价层电子对数为3+0=3,故其空间构型为平面三角形;
(4)M和R所形成的一种离子化合物为Na2O,晶胞中黑色球数目为8,白色球数目为8×1/8+6×1/2=4,黑色球与白色球数目之比为2:1,故图中黑球代表的离子是Na+;Na+的配位数为4,晶胞相当于4个Na2O,晶胞参数a="b=c=d" pm,晶体的体积为(d×10-10)3cm,则晶体的密度为m/V=(4×62)÷[NA×(d×10-10)3]g/cm。
(5)Z的最高价含氧酸的钾盐(橙色)为K2Cr2O7,与氧元素的氢化物发生氧化还原反应,该氢化物为H2O2,在稀硫酸中,Cr元素被还原为+3价,H2O2被氧化生成氧气,反应方程式为:3H2O2+K2Cr2O7+4H2SO4=Cr2(SO4)3+3O2↑+7H2O+K2SO4。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案