题目内容
【题目】【物质结构与性质】钛被称为“国防金属”和“生物金属”,是重要的结构材料。
(1)基态钛原子的核外电子排布式是 。
(2)金红石(TiO2)的熔点1825℃,用熔盐法直接电解金红石可获得金属钛,金红石所属的晶体类型是 晶体。
(3)TiCl4能与NH4Cl反应生成配合物(NH4)2[TiCl6]。
①此配合物中,形成配位键时提供孤对电子的有 。(填元素符号)
②与NH4+互为等电子体的一种阴离子为 。(填化学式)
(4)TiO2+与H2O2在稀酸中反应生成橘红色的[TiO(H2O2)]2+离子,可用于钛的定性检验。下列关于H2O2的说法正确的是 。(填序号)
A.空间构型为直线形 |
B.含非极性键的极性分子 |
C.O原子轨道杂化类型为sp3 |
D.化学性质不稳定是因为氢键的键能较小 |
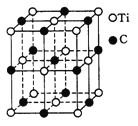
(5)最近发现一种由钛(Ti)原子和碳原子构成的气态团簇分子,结构模型如图所示,它的分子式为 。
【答案】(1)1s22s22p62s23p63d24s2或[Ar]3d24s2
(2)离子 (3)BH4-(4)BC (5)Ti14C13
【解析】试题分析:(1)钛原子的核电荷数为22,其基态钛原子的核外电子排布式是1s22s22p62s23p63d24s2或[Ar]3d24s2;
(2)金红石(TiO2)的熔点1825℃,用熔盐法直接电解金红石可获得金属钛,说明高熔点且高温下能发生电离,可知金红石为离子晶体。
(3)①配合物(NH4)2[TiCl6]中,N和Cl原子均有孤对电子,可与中心原子Ti形成配位键;
②等电子体是指具有相同电子数目和原子数目的分子或离子,NH4+中电子数为:7+4-1=10,原子数为5,其中BH4-与之互为等电子体的阴离子;
(4)A.H2O2分子中氧原子形成2个σ键,含有2对孤电子对,O原子及其连接的H原子、O原子形成V形结构,H2O2分子的空间构型不是直线形,为展开书页形结构,故A错误;B.H2O2分子中含有O—O非极性键和O—H极性键的极性分子,故B正确;C.H2O2分子中O原子轨道杂化类型为sp3,故C正确;D.键能只影响物理性质,不影响化学性质,故D错误;答案为BC;
(5)根据题意知,图给结构就是其分子结构,分子中含有的原子就是其化学式中含有的原子,直接数出其中的Ti原子和C原子个数即可,其分子式为Ti14C13。