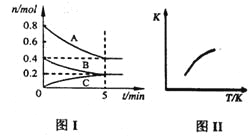
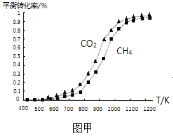
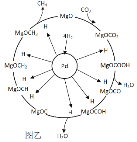
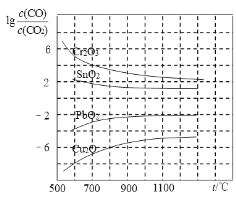
题目内容
【题目】下列元素中原子半径最大的是( )
A.F
B.O
C.Mg
D.Al
【答案】C
【解析】解:同周期自左而右原子半径减小,故原子半径:B>O>F,Mg>Al,同主族自上而下原子半径增大,Al>B,故原子半径Mg>Al>O>F,故选C.
【考点精析】解答此题的关键在于理解微粒半径大小的比较的相关知识,掌握同周期元素的原子或最高价离子半径从左到右逐渐减小(稀有气体元素除外);电子层数相同,核电荷数越大半径越小;核电荷数相同,电子数越多半径越大;电子数和核电荷数都不同的,一般通过一种参照物进行比较;具有相同电子层结构的离子,一般是原子序数越大,离子半径越小.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目