��Ŀ����
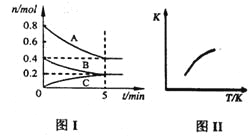
����Ŀ������ͬ�¶��£������Ϊ1 L���ĸ��ܱ������У������¶Ⱥ��ݻ����䣬�����ֲ�ͬ��Ͷ�Ϸ�ʽ���з�Ӧ��ƽ��ʱ�й�������������֪2SO2��g����O2��g�� ![]() 2SO3��g����H����196.6 kJ��mol��1����
2SO3��g����H����196.6 kJ��mol��1����
���� | �� | �� | �� | �� |
��ʼͶ���� | 2molSO2 1mol O2 | 1 mol SO2 0.5mol O2 | 2mol SO3 | 2mol SO2 2mol O2 |
��Ӧ�ų������յ�������kJ�� | a | b | c | d |
ƽ��ʱc��SO3�� ��mol��L��1�� | e | f | g | h |
���й�ϵ��ȷ������ ��
A��a��c��e��g B��a>2b��e>2f C��a>d��e>h D��c��98.3e>196.6
���𰸡�B
��������
���������A����������ʼʱ��Ӧ������Ӧ������У�����������ʼʱ��Ӧ���淴Ӧ������У���Ȼ����ǵ�Чƽ�⣬��a+c=196.6����A����ȷ��B����������������Ϊԭ����2�������ƽ��ʱ������������Ũ����ȣ����ų����������ҵ�2�����ֽ��������ٻָ�Ϊԭ�������������ѹ��ƽ��������Ӧ�����ƶ�������������࣬����a��2b��ͬ����e��2f����B��ȷ��C�����е�O2�ɿ������ڼ�ƽ����ٳ���1 mol O2����ƽ�������ƶ����������࣬����a��d��ͬʱ��e��h����C����ȷ��D�����ݷ�Ӧ��
2SO2+O2![]() 2SO3��H=-196.6 kJmol-1
2SO3��H=-196.6 kJmol-1
2 196.6
e a
���a=98.3e����ѡ��A������֪��a+c=196.6����98.3e+c=196.6����D����ȷ����ѡB��

 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�