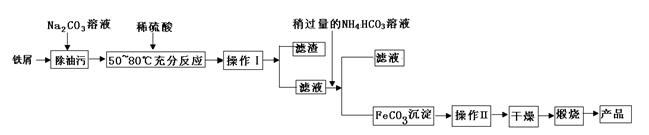
题目内容
铁矿石主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。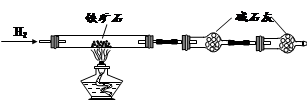
A B C
Ⅰ.铁矿石中含氧量的测定
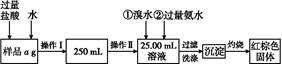
① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③ 从左端导气管口处缓缓通入H2,____________,点燃A处酒精灯
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为________________________________________________。
(2)③中点燃A处酒精灯前所需操作为 ______________________________ 。
(3)测得反应后装置B增重1.35g,则铁矿石中氧的百分含量为____________。
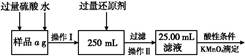
Ⅱ.铁矿石中含铁量的测定
(1)步骤④中煮沸的作用是__________________________________________。
(2)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、____________。
(3)下列有关步骤⑥的操作中说法正确的是__________________。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定颜色变化后,30s内溶液不恢复原来的颜色再读数
(4)若滴定过程中消耗0.5000mol·L?1KI溶液20.00mL,则铁矿石中铁的百分含量为____________。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 。
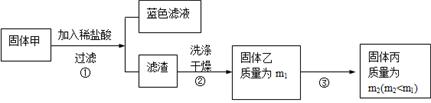
如何检验滤液A中是否含有Fe2+__________(填选项字母)。
A.先加KSCN溶液,再加氯水 B.加NaOH溶液 C.加K3[Fe(CN)6]
Ⅰ.(1)防止空气中的水蒸气和CO2进入B中,影响测定结果。
(2)检验氢气的纯度 (3)24%
Ⅱ.(1)赶走溶液中溶解的过量的Cl2
(2)250mL容量瓶 (未答“250mL”不给分)(3)df (4)70%
Ⅲ. Fe5O6 C
解析试题分析:
Ⅰ.(1)B中的碱石灰是吸收置换反应生成的水的,为了防止空气成分对实验的影响,要加一个装置吸收空气中的水分和二氧化碳
(2)点燃氢气之前要先检验氢气的纯度,以防爆炸
(3)反应后装置B增重1.35g,既氢气和氧化铁反应后固体质量的增加值,可以根据差量法来计算;反应实质,增加的是氧元素的质量,所以氧元素的质量分数是(1.35/18)×16/5.0×100%=24%
Ⅱ.
(1)煮沸可以将水中的气体赶走;
(2)根据稀释液体和配制一定体积的溶液所选择的仪器来回答,容量瓶是一种定容仪器。
(3)根据滴定试验以及滴定过程中的实验误差分析知识来回答。
碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需要加指示剂,a错误;
滴定过程中,三价铁可以和碘离子发生反应生成亚铁离子和碘单质,碘单质遇到淀粉溶液显示蓝色,但是亚铁离子的绿色会产生干扰作用,b错误
滴定管用蒸馏水洗涤后必须再用标准液洗涤,c错误
滴定过程中,眼睛应注视容量瓶液体中发生的变化
(4)根据元素守恒和化学反应方程式进行计算
由于所取溶液(含Fe3+)的体积与消耗KI溶液的体积相等,结合方程式可知,c(Fe3+)=c(KI)=0.5mol/L,所以铁元素的百分比含量为70%
Ⅲ.根据铁元素质量分数和氧元素质量分数计算出铁的氧化物的化学式,铁的质量分数是70%,氧元素的质量分数是24%,所以100g铁矿石中,铁元素的质量是70g,氧元素的质量是24g,铁元素和氧元素的物质的量比为(70/50):(24/16)=5:6,铁的氧化物的化学式为Fe5O6
考点:考查对化合物的性质掌握及实验操作

 阅读快车系列答案
阅读快车系列答案(16分)铜与浓硫酸反应,实验装置如图所示。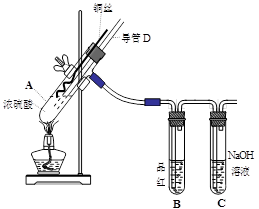
(1) 装置A中发生反应的化学方程式为: ,反应过程中试管B中的现象是 ,试管C的作用是 。
(2) 导管D的下端(虚线段)应位于 (液面上、液面下),导管D的作用有:①实验结束后排除装置中的SO2;② 。
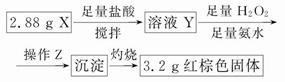
实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有CuO、Cu2O、CuS、Cu2S。为探究甲的成分,进行了以下的实验。
查阅资料可知:Cu2O + 2HCl =CuCl2+ Cu + H2O, 2Cu2O + O2煅烧 4CuO,2CuS+3O2煅烧2CuO+2SO2,Cu2S+2O2煅烧2CuO+SO2。CuS、 Cu2S和稀HCl不反应。
|
 (3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有: 。
(3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有: 。(4) 煅烧过程中,除上述反应外,还可能发生反应的方程式为 。
(5)结论:甲中有CuO,还肯定含有的物质是 。
硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等。
(1)新制的绿矾(FeSO4·7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式: 。
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;
SO3熔点是16.8℃,沸点是44.8℃。
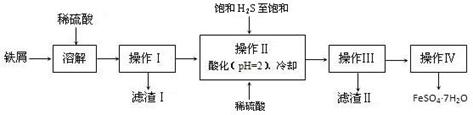
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”。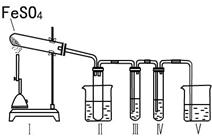
上述装置Ⅲ和Ⅳ用来检验气体产物。试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在 (选填“0℃、25℃、50℃”),装置Ⅱ的作用是 。
②装置Ⅲ中的试剂可以是 (选填序号,下同),现象是 ,则证明气体产物中含有SO2; 装置Ⅳ中的试剂可以是 。
| A.2 mol/LNa2CO3溶液 |
| B.品红溶液 |
| C.0.5 mol/LBaCl2溶液 |
| D.0.5 mol/LBa(NO3)2 |
F. 淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为 。
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如
下实验:
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入 。 | | 固体中含有Fe2O3 |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液。 | 产生蓝色沉淀 | |
⑤若用22.8 g FeSO4固体做实验,完全分解后,得到11.2 g固体,其中Fe2O3的质量分数=
(精确到0.1%)
小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”,现邀你一起走进他的化学课堂。
(1)课前老师布置了下列预习作业,请你一起完成:
①铁不同价态的物质各写一种(并标出铁元素的化合价):_____、_______、 ________。
②写出一个它们之间相互转化(含三种价态)的化学方程式:___________________ 。
(2)实验室提供的下列试剂:锌粒、铁粉、0.1 mol·L-1 FeCl3溶液、0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性。
根据氧化还原反应的有关原理,小明说Fe2+既有还原性又有氧化性,为证实自己的假设,请你和小明一起设计实验方案,进行实验并描述实验现象,完成下列表格。
| 探究内容 | 实验方案 | 实验现象 |
| 探究Fe2+具有还原性 | 取少量0.1 mol·L-1 FeCl2溶液,加入足量__________后,再往溶液中加入少量__________ | 溶液变成血红色 |
| 探究Fe2+具有氧化性 | 取少量0.1 mol·L-1 FeCl2溶 液,加入_________充分 反应 | 溶液由浅绿色变无色 所发生反应离子方程式为________________ [来源:Z|xx|k.Com] |