题目内容
铁及其化合物在生产和生活中有着广泛的应用。
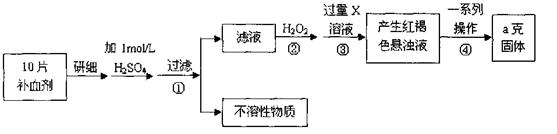
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:回答下列问题: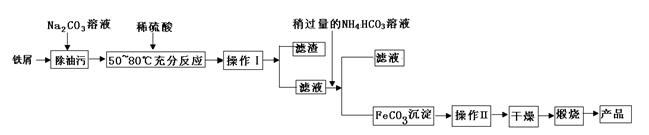
①操作Ⅰ、Ⅱ的名称分别是____、____。
②写出在空气中煅烧FeCO3的化学方程式 ;
③煅烧如果不充分,产品中将有Fe2+存在,试设计实验检验产品中有无Fe2+。
(2)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定。称取2.850g绿矾(FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;量取25.00mL待测溶液于锥形瓶中;用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①写出酸性KMnO4溶液与FeSO4溶液反应的离子方程式
②计算上述样品中FeSO4·7H2O的质量分数为 [已知M(FeSO4·7H2O)=278g/mol]
③滴定达到终点时锥形瓶中溶液颜色变化为
④下列操作会导致样品中FeSO4·7H2O的质量分数的测定结果偏高的有_____________。
a.未干燥锥形瓶
b.盛装标准液的滴定管没有用标准液润洗
c. 滴定终点时滴定管尖嘴中产生气泡
d.量取待测液,视线注视刻度时开始平视、结束俯视
(1)①过滤、洗涤(各1分)
②4FeCO3+O2 2Fe2O3+4CO2(2分)
2Fe2O3+4CO2(2分)
③取固体样品少许放置试管中,加入足量稀硫酸,振荡试管,再加入几滴KMnO4溶液。如果溶液褪色,则有Fe2+ (3分)
(2)①5Fe2++MnO4-+8H+=Fe3++2Mn2++4H2O(2分)
②0.9754(2分)
③溶液由浅绿色变成紫红色,且半分钟内不立即退去(2分)
④b d(2分)
解析试题分析:(1)①操作I后得到滤渣和滤液,所以应为过滤,沉淀干燥前应先洗涤除去杂质。②+2价铁在空气中加热易被氧化为+3价,即Fe2O3。③检验Fe2+可以选用氧化剂,为了使现象更加明显可选用KMnO4。(2)②计算时注意取的待测溶液是25 mL,所以最后FeSO4·7H2O)质量分数=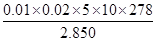 =0.9754。④a项,锥形瓶内有水对结果无影响,b项,滴定管未润洗相当于将标准液稀释,所用标准液体积增大,故结果偏高;c项,终点时产生气泡,读取体积偏小,结果偏低;d项,取待测液结束时俯视导致所取待测液体积偏大,消耗标准液体积偏大,结果偏高。
=0.9754。④a项,锥形瓶内有水对结果无影响,b项,滴定管未润洗相当于将标准液稀释,所用标准液体积增大,故结果偏高;c项,终点时产生气泡,读取体积偏小,结果偏低;d项,取待测液结束时俯视导致所取待测液体积偏大,消耗标准液体积偏大,结果偏高。
考点:考查物质制备,考查考生对物质制备的设计能力。

下列关于氯的说法正确的是
| A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂 |
| B.若1735Cl、1737Cl为不同的核素,有不同的化学性质 |
| C.实验室制备Cl2,可用排饱和食盐水法收集 |
| D.1.12 LCl2含有1.7NA个质子(NA表示阿伏伽德罗常数) |