题目内容
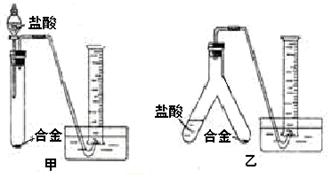
(16分)铜与浓硫酸反应,实验装置如图所示。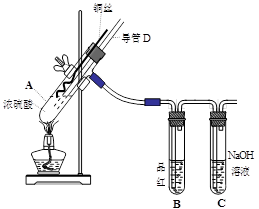
(1) 装置A中发生反应的化学方程式为: ,反应过程中试管B中的现象是 ,试管C的作用是 。
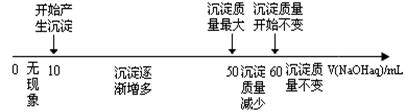
(2) 导管D的下端(虚线段)应位于 (液面上、液面下),导管D的作用有:①实验结束后排除装置中的SO2;② 。
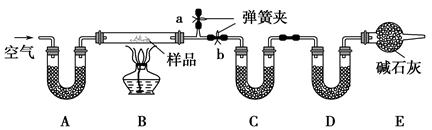
实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有CuO、Cu2O、CuS、Cu2S。为探究甲的成分,进行了以下的实验。
查阅资料可知:Cu2O + 2HCl =CuCl2+ Cu + H2O, 2Cu2O + O2煅烧 4CuO,2CuS+3O2煅烧2CuO+2SO2,Cu2S+2O2煅烧2CuO+SO2。CuS、 Cu2S和稀HCl不反应。
|
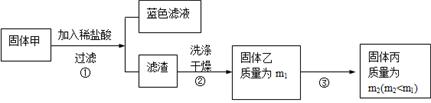 (3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有: 。
(3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有: 。(4) 煅烧过程中,除上述反应外,还可能发生反应的方程式为 。
(5)结论:甲中有CuO,还肯定含有的物质是 。
33.(16分)(1)Cu +2H2SO4(浓) △CuSO4+SO2↑+2H2O (2分)、品红溶液褪色(2分)、吸收多余的SO2,防止污染空气(2分)
(2)液面下;防倒吸 (4分)
(3)泥三角、坩埚(坩埚钳)(2分,坩埚钳不写不扣分)
(4)2Cu+O2△2CuO (2分)
(5)CuS(2分)
解析试题分析: (1) 该实验研究的是铜与浓硫酸的反应,因此在A装置中发生的反应方程式为Cu +2H2SO4(浓) △CuSO4+SO2↑+2H2O。反应中有SO2生成,因此B中的品红溶液被漂白褪色,C试管起到吸收过量SO2的目的,防止SO2污染空气。
(2) 由于A装置是制备SO2的发生装置,所以导管D的下端必须插入溶液中,才能防止产生的SO2不会从导管D中逸出来;而导管D的作用是在实验结束后用于排除A装置的SO2,同时能够平衡A和B中气压,防止B中液体倒吸。具体操作就是把D下端从溶液中提起。
(3) 煅烧的实验用具必须使用耐高温的坩埚,而与坩埚配套使用的还有泥三角、坩埚钳等。
(4)根据题中的判断,该固体甲可能是CuO、Cu2O、CuS、Cu2S,因此用稀盐酸溶解,根据已知的反应,反应得到的固体乙可能是Cu、CuS、Cu2S,对固体乙进行煅烧,因此除了已知的几个煅烧反应外,还可能发生的反应为单质铜的煅烧2Cu+O2△2CuO。
(5) 根据(4)的分析,利用反应的方程式对各种成分煅烧结果进行推断分析,若Cu煅烧,煅烧生成CuO使质量增重;若CuS煅烧,煅烧产生CuO使质量减小;若Cu2S煅烧,煅烧生成CuO是质量不变。因此要满足流程中煅烧前后质量减小,则固体中必须还含有能使煅烧前后质量减小的CuS。
考点:本题考查的是

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(15分)Fe2O3俗称氧化铁红,常用作油漆着色剂。工业以煤矸石(主要成分:SiO2 49.5%;Fe2O3 20.6%;Al2O318.9%,以及MgO、FeO等其他杂质)制备并研究氧化铁红的应用。
(一)制备氧化铁红
1.预处理:将煤矸石粉碎,在350℃下焙烧2小时。
2.加酸溶解:将预处理后的煤矸石溶于质量分数为15%过量的硫酸溶液中,过滤。在滤液中加入的H2O2。
3.调节pH:在上述滤液中加1mol/LNaOH溶液调节溶液的pH,再过滤,得到滤渣。
4.产品处理:将滤渣进行水洗、烘干、煅烧、研磨、过筛得产品。
已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.3 | 3.3 | 7.5 | 10.3 |
| 完全沉淀 | 2.8 | 5.2 | 9.7 | 12.2 |
(1)预处理时,将煤矸石焙烧2小时的目的是 。
(2)酸浸操作中,过量H2SO4的作用是 。
在实验室中进行该操作时,用到玻璃仪器有 、 。
(3)用NaOH溶液调节pH的最佳范围是 。若从第二次过滤的滤液中获取较纯净的硫酸镁晶体,应补充的操作是 、洗涤后,干燥即得。
(4)产品处理时,对滤渣水洗的操作是 。
(二)分析与讨论:
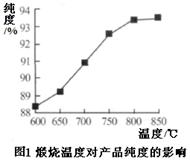
(5)产品处理时,煅烧温度对产品的纯度有很大影响。已知温度对产物纯度的影响如图1所示,则煅烧时温度最好控制在 ℃。
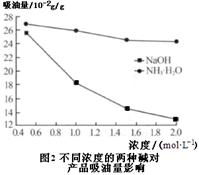
(6)吸油量是反映氧化铁红表面性质的重要指标。吸油量大,说明氧化铁红表面积较大,则用在油漆中会造成油漆假稠,影响质量。不同浓度的两种碱溶液对产物吸油量影响如图2所示,则上述生产中在调节溶液pH时,选用NaOH溶液而不选用氨水的原因是 。
某实验小组欲通过以下实验来探究Na2CO3和NaHCO3两种物质的性质。
(1)称取两种固体各2 g,分别放入两个小烧杯中,再各滴加10 mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,向所得溶液中各滴入2滴酚酞试液。
① 发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得到结论 。
② 同学们在两烧杯中还观察到了其它现象。其中,盛放Na2CO3的烧杯中出现的现象是 (填字母序号)。
A.溶液温度下降 B.溶液温度升高 C.滴入酚酞后呈浅红色 D.滴入酚酞后呈红色
(2)如下面左图所示分别加热A、B固体,发现固体A受热产生的气体能使澄清石灰水变浑浊,但一段时间后浑浊又变澄清。请用化学方程式解释澄清石灰水中发生的现象 。

(3)如上图所示,在气密性良好的装置I和II中分别放入试剂,将气球内的固体同时倒入试管中。
两试管中均产生气体, (填“I”或“II”)的反应程度更为剧烈。
② 反应结束后,气球均有膨胀,恢复至室温。下列说法正确的是 。
A.装置I的气球体积较大 B.装置II的气球体积较大
C.生成气体的体积根据盐酸计算 D.生成气体的体积根据固体计算
(4)将两种固体分别配制成0.5 mol·L-1的溶液,探究与0.5 mol·L-1CaCl2溶液反应的情况
| 实验方案 | 预测现象 | 预测依据 | 实际结果 |
| 实验1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 有白色 沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应。 | 有白色沉淀 |
| 实验2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 无白色 沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 | 有白色沉淀出现,同时有少量气泡冒出。 |
请写出上述实验过程中发生的反应的离子方程式:
实验1: ;实验2: 。
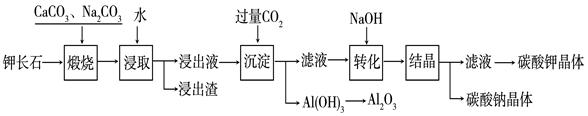
 Al(OH)3 + OH— ,“浸取”时应保持溶液呈 性(填“酸”或“碱”)。
Al(OH)3 + OH— ,“浸取”时应保持溶液呈 性(填“酸”或“碱”)。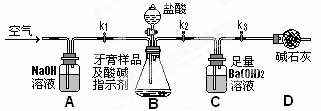
 测定生成气体的体积
测定生成气体的体积  测定生成气体的体积
测定生成气体的体积 称量灼烧产物的质量。
称量灼烧产物的质量。