题目内容
15.哈伯因发明用氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生N2+3H2?2NH3.下列说法正确的是( )| A. | 达到化学平衡时,N2完全转化为NH3 | |
| B. | 一定条件下达到化学平衡时,N2、H2和NH3的物质的量浓度之比为1:3:2 | |
| C. | 单位时间内消耗a mol N2同时消耗2amol NH3,说明该反应已达到平衡状态 | |
| D. | 达到化学平衡时,正反应和逆反应速率相等,且都为零 |
分析 该反应为可逆反应,反应物不可能完全转化,得到平衡时,正逆反应速率相等,但不为0,各物质的浓度不再发生改变,以此解答该题.
解答 解:A.反应为可逆反应,N2不可能完全转化为NH3,故A错误;
B.向一密闭容器中充入1mol N2和3mol H2,由于转化率不能确定,则不能确定氨气与氮气和氢气的物质的量的关系,但N2、H2的物质的量浓度比为1:3,故B错误;
C.单位时间内消耗a mol N2同时消耗2amol NH3,则正逆反应速率相等,说明该反应已达到平衡状态,故C正确;
D.达到化学平衡时,正逆反应速率相等,但不为零,故D错误.
故选C.
点评 本题考查较为综合,涉及可逆反应以及化学平衡状态的判断,题目难度不大,注意把握可逆反应的特点以及平衡状态的标志.

练习册系列答案
相关题目
5.将等质量的铜片在酒精灯上加热后,分别插入溶液中,放置片刻铜片质量减小的是( )
| A. | 水 | B. | 无水乙醇 | C. | 石灰水 | D. | 盐酸 |
6.下列叙述正确的是( )
| A. | 淀粉和纤维素在一定条件下水解均可得到葡萄糖 | |
| B. | 煤的干馏属于物理变化 | |
| C. | 油脂在酸性或碱性条件下的水解反应叫做皂化反应 | |
| D. | 石油分馏得到的各馏分都是纯净物 |
7.下列说法正确的是( )
| A. | 糖类、蛋白质、油脂属于天然高分子化合物 | |
| B. | 煤、天然气、植物油都属于化石燃料 | |
| C. | 纤维素和淀粉水解的最终产物都是葡萄糖 | |
| D. | 能与NaOH溶液反应且分子式为C2H4O2的有机物是乙酸 |
4.已知短周期元素的离子aAm+、bBn+、cCm-、dDn-(m>n)都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径:A>B>C>D | |
| B. | 离子的还原性:cCm-比dDn-弱 | |
| C. | 离子半径:C>D>B>A | |
| D. | 气态氢化物的稳定性HmC一定大于HnD |
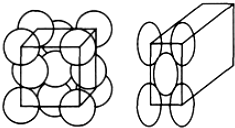
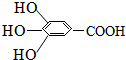 300多年前,著名的化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水.没食子酸的结构式如图所示:
300多年前,著名的化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水.没食子酸的结构式如图所示: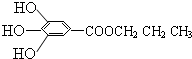
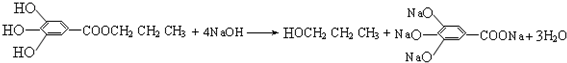 .
.

 (1)实验室用如图所示装置制备少量乙酸乙酯.
(1)实验室用如图所示装置制备少量乙酸乙酯. .试回答:
.试回答: +2Na→
+2Na→ +H2↑.
+H2↑.