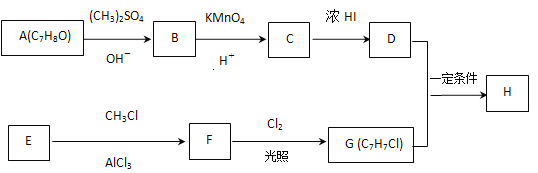
题目内容
【题目】I. 某可逆反应在某体积为2L的密闭容器中进行,在从0~3min各物质的量的变化情况如图所示(A、B、C均为气体)。

(1)该反应的化学方程式为______。
(2)反应开始至2min时,B的平均反应速率为______。
(3)能说明该反应已达到平衡状态的是______。
A. c(A)= c(B)= c(C) B.容器内压强保持不变
C .v逆(A)= v正(C) D. c(C)不再变化
(4)由图求得A的平衡时的转化率为______。
Ⅱ.(5)已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表
共价键 | H—H | N—H | N≡N |
能量变化/kJ·mol-1 | a | b | c |
则合成氨反应:N2(g) + 3H2 (g)= 2NH3(g) ![]() H = ______kJ·mol-1
H = ______kJ·mol-1
【答案】2A+B![]() 2C 0.25 mol·L-1·min-1 BCD 0.4(或40%) 3a+c-6b
2C 0.25 mol·L-1·min-1 BCD 0.4(或40%) 3a+c-6b
【解析】
从图中可以看出A和B的物质的量在减少,C的物质的量在增多,所以A和B是反应物,C是生成物。两分钟后A、B、C的物质的量不再改变,所以该反应是一个可逆反应。在两分钟内A的物质的量减少了2mol,B的物质的量减少了1mol,C的物质的量增加了2mol,所以A、B、C的系数比为2:1:2。所以该反应的化学方程式为:2A+B![]() 2C;
2C;
(2)反应开始至两分钟,B的物质的量变化了1mol,那么B的浓度变化了1mol/2L=0.5mol/L,用B表示的平均反应速率为0.5mol/L÷2min=0.25mol/(L·min);
(3)A.各物质的浓度不再变化,可以说明该反应达到平衡状态,而各物质的浓度相等不能说明浓度不再变化,故A不选;
B.该反应是一个反应前后气体系数之和不等的反应,在密闭容器中压强不再变化,说明反应达到了平衡状态,故B选;
C.用A表示的逆反应速率和用C表示的正反应速率相等,而A和C的系数相同,表明正逆反应速率相等,说明达到化学平衡状态,故C选;
D.C的浓度不再变化,说明反应达到平衡状态,故D选。
故选BCD。
(4)在两分钟内到平衡状态时,转化的A是2mol,起始时A是5mol,所以A的转化率是2mol/5mol×100%=40%;
(5)在合成氨反应中,断裂1mol N≡N的同时会断裂3mol H—H,形成6mol N—H。旧键断裂吸收的能量为3a+c,新键形成放出的能量为6b,所以合成氨的![]() H=(3a+c-6b) kJ·mol-1。
H=(3a+c-6b) kJ·mol-1。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案【题目】下表是元素周期表短周期的一部分
① | ||||||||
② | ③ | ④ | ||||||
⑤ | ⑥ | ⑦ | ⑧ | |||||
(1)①-⑦元素中金属性最强的元素位于周期表中的位置为______________________。
(2)③与⑤形成的化合物溶于水会剧烈反应生成白色沉淀和气体A,请写出该反应的化学方程式 ___________________ ,气体A的实验室制备化学方程式为______________。
(3)④所形成的单质与水反应的方程式 _____________,该反应的类型是_______反应。
(4)②、③、⑦的最高价含氧酸的酸性由弱到强的顺序是__________________(用化学式表示);④所在族的各元素与氢气化合所形成的气态氢化物稳定性由强到弱的顺序是(用化学式表示)__________________。
(5)表中元素③、⑥它们最高价氧化物的水化物相互反应的离子方程式为_____________。
【题目】现在部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
T | M层上有6个电子 |
Z | 元素最高正价是+7价 |
W | 其单质既能跟酸反应,又能跟碱反应,都产生H2 |
用相应的元素符号或化学式回答以下问题
(1)元素X的一种同位素中子数比质子数多1,这种同位素的符号是______。
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式______。
(3)元素Z与元素T相比,非金属较强的是______(用元素符号表示)。
(4)T、X、Y、Z四种元素的最高价氧化物对应的水化物中酸性最强的是______(化学式)
(5)T的最高价氧化物对应的水化物与W的最高价氧化物对应的水化物反应的离子方程式为______。