题目内容
【题目】已知 Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g) 在不同温度下的平衡常数如表:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 42.9 | 50.7 | 64.0 |
请回答下列问题:
(1)该反应的平衡常数表达式 K= , △H0(填“>”、“<”或“=”).
(2)在一个容积为10L的密闭容器中,1300℃时加入 Fe、Fe2O3、CO、CO2各1mol,反应经过10min 后达到平衡.求该时间范围内反应的平均反应速率 v(CO2)= , CO 的平衡转化率为 .
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 .
A.增加Fe2O3的量
B.加入合适的催化剂
C.移出部分CO2
D.提高反应温度.
【答案】
(1)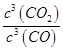 ;>
;>
(2)0.006mol/(L?min);60%
(3)CD
【解析】解:(1)Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g) 的K= ![]() ,由表格数据可知,温度越高,K越大,正反应为吸热反应,△H>0,
,由表格数据可知,温度越高,K越大,正反应为吸热反应,△H>0,
所以答案是: ![]() ;>;(2)1300℃时K=64,反应经过10min 后达到平衡,Qc=1<K,平衡正向移动,设转化的CO为x,则
;>;(2)1300℃时K=64,反应经过10min 后达到平衡,Qc=1<K,平衡正向移动,设转化的CO为x,则
Fe2O3(s)+ | 3CO(g)2Fe(s)+ | 3CO2(g) | |
起始 | 1 | 1 | |
转化 | x | x | |
平衡 | 1-x | 1+x |
可知 ![]() =64,解得x=0.6;
=64,解得x=0.6;
v(CO2)= ![]() =0.006mol/(Lmin),
=0.006mol/(Lmin),
CO 的平衡转化率为 ![]() ×100%=60%,
×100%=60%,
所以答案是:0.006mol/(Lmin);60%;(3)A.增加Fe2O3的量,平衡不移动,故A不选;
B.加入合适的催化剂,平衡不移动,故B不选;
C.移出部分CO2,平衡正向移动,CO的转化率增大,故C选;
D.该反应为吸热反应,提高反应温度,平衡正向移动,CO的转化率增大,故D选;
所以答案是:CD.
【考点精析】关于本题考查的化学平衡的计算,需要了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能得出正确答案.