题目内容
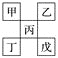
【题目】观察如图所示装置,在通电一段时间后,铁电极的质量增加了5.4g. 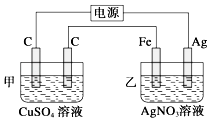
(1)经分析知,甲池是(填“原电池”或“电解池”);乙池中,银电极为极(填“阳极”或“阴极”或“正极”或“负极”).
(2)乙池中银电极的电极方程式为 , 根据题目所示数据,电路中转移了mol 电子.
【答案】
(1)电解池;阳
(2)Ag﹣e﹣=Ag+;0.05
【解析】解:(1)该装置连有电源,所以甲池是电解池,通电一段时间后发现乙烧杯中铁电极的质量增加了5.4g,则铁做电解池阴极,银做阳极,
所以答案是:电解池;阳;(2)乙池中银做阳极,银电极的电极方程式为Ag﹣e﹣=Ag+,铁做电解池阴极,电极反应为:Ag++e﹣=Ag,又铁电极的质量增加了5.4g,所以电路中转移了 ![]() =0.05mol 电子
=0.05mol 电子
所以答案是:Ag﹣e﹣=Ag+;0.05.

 每课必练系列答案
每课必练系列答案【题目】已知 Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g) 在不同温度下的平衡常数如表:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 42.9 | 50.7 | 64.0 |
请回答下列问题:
(1)该反应的平衡常数表达式 K= , △H0(填“>”、“<”或“=”).
(2)在一个容积为10L的密闭容器中,1300℃时加入 Fe、Fe2O3、CO、CO2各1mol,反应经过10min 后达到平衡.求该时间范围内反应的平均反应速率 v(CO2)= , CO 的平衡转化率为 .
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 .
A.增加Fe2O3的量
B.加入合适的催化剂
C.移出部分CO2
D.提高反应温度.
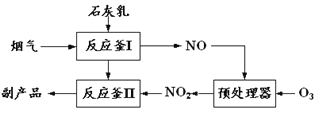
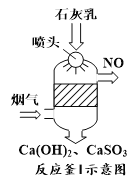
【题目】2018年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-A kJ·mol-1
②2N2(g)+CO2(g)+2H2O(g)=CH4(g)+4NO(g) ΔH=+ B kJ·mol-1
③2H2O(g)=2H2O(l) ΔH=-C kJ·mol-1
请写出CH4(g)与NO2(g)反应生成N2(g),CO2(g)和H2O(l)的热化学方程式__________________ 。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
物质 浓度(mol/L)时间(min) | NO | N2 | CO2 |
0 | 0.0100 | 0 | 0 |
10 | 0.0058 | 0.0021 | 0.0021 |
20 | 0.0040 | 0.0030 | 0.0030 |
30 | 0.0040 | 0.030 | 0.0030 |
40 | 0.0032 | 0.0034 | 0.0017 |
50 | 0.0032 | 0.0034 | 0.0017 |
①下列说法能作为判断该反应达到化学平衡状态标志的是_______
A.活性炭的质量
B.v 正(N2) = 2v逆 (NO)
C.容器内压强保持不变
D.容器内混合气体的密度保持不变
E.容器内混合气体的平均相对分子质量保持不变
F.容器内CO2的浓度保持不变
②压强平衡常数Kp,仅适用于气相平衡,以分压表示各成分的浓度,分压PA=P总 X nA%在T0C时,平衡总压为P,该反应的压强平衡常数的计算式为______________;
③在30 min时,若只改变某一条件,反应重新达到平衡,则改变的条件是___________;
④在50 min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则化学平衡_______(填“正向移动”、“逆向移动”或“不移动”)