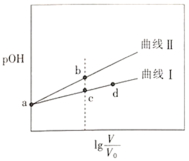
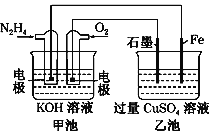
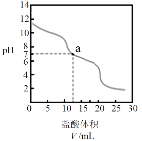
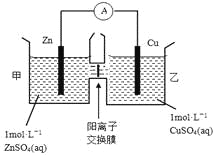
题目内容
【题目】4molA和4molB在2L的密闭容器中发生如下反应:2A(g)+B(g)=2C(g)+D(g)。前15s,A的平均反应速率为0.12mol·(L·s)1,则15s时,容器中B的物质的量为( )
A.2.2molB.3.2molC.1.8molD.2.8mol
【答案】A
【解析】
前15s,A的平均反应速率为0.12mol/(Ls),由反应速率之比等于化学计量数之比可计算B的速率,再结合v=![]() 解答。
解答。
前15s,A的平均反应速率为0.12mol/(Ls),由反应速率之比等于化学计量数之比可知,B的反应速率为0.12mol/(L s)×![]() =0.06mol/(Ls),所以转化的B为0.06×15×2=1.8mol,则15s时,容器中B的物质的量为4mol-1.8mol= 2.2mol。
=0.06mol/(Ls),所以转化的B为0.06×15×2=1.8mol,则15s时,容器中B的物质的量为4mol-1.8mol= 2.2mol。
答案选A。

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
【题目】高温下CO2和H2S发生如下反应:CO2(g) +H2S(g)COS(g) +H2O(g)。有关实验数据如下:
实验 | 温度 | 物质的起始物质的量/(mol) | 平衡时COS物质的量/(mol) | |
n(CO2) | n(H2S) | n(COS) | ||
I | 337℃ | 0.10 | 0.40 | 0.01 |
II | 347℃ | 0.10 | 0.40 | 0.015 |
下列说法不正确的是
A.该反应为吸热反应
B.实验I达平衡后COS的物质的量分数为5%
C.实验I温度下,反应的平衡常数为![]()
D.平衡后向II中再充入0.10 mol CO2和0.40 mol H2S,相同温度下再达平衡时n(COS)=0.03mol