题目内容
【题目】侯氏制碱法又称联合制碱法,是我国化学工程专家侯德榜于1943年发明的。此方法具有食盐利用率高、对环境的污染少、生产成本低等优点。其制备中涉及如下两个反应:NaC1+H2O+CO2+NH3===NaHCO3↓+NH4Cl、2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
(1)基态氯原子的电子排布式为______,C、N、O三种元素第一电离能由大到小的顺序为____。
(2)①H2O、CO2、NH3三种分子中属于V形分子的是_______。
②在常温常压下,1体积水可溶解700体积NH3、可溶解0.8体积CO2,试解释其原因:_________。
(3)Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是________(填“极性”或“非极性”)分子,由此推知[Cu(NH3)4]2+的空间构型是________。
(4)①要确定Na2CO3固体是晶体还是非晶体,最可靠的方法是_____。
②下列事实不能支持Na2CO3的晶体类型为离子晶体的是______(填字母)。
a.熔点为851℃ b.晶体中存在Na+、CO![]()
c.可溶于水 d.晶体中存在离子键,共价键
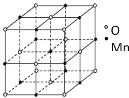
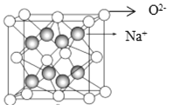
(5)钠、氧两元素可形成两种常见化合物,其中一种的晶胞如下图所示,则该氧化物的化学式为________,若晶胞参数为d pm,晶胞的密度为![]() ,则阿伏加德罗常数NA=______(用含d、ρ的代数式表示)。
,则阿伏加德罗常数NA=______(用含d、ρ的代数式表示)。
【答案】1s22s22p63s23p5或[Ne]3s23p5 N>O>C H2O CO2是非极性分子而水是极性分子,故CO2在水中溶解度较小,NH3是极性分子且能与水分子形成分子间氢键,故NH3在水中溶解度很大 极性 平面正方形 X-射线衍射法 c Na2O ![]()
【解析】
(1)氯原子核外有17个电子,根据能量最低原理,基态氯原子的电子排布式为1s22s22p63s23p5或[Ne]3s23p5;N原子2p轨道上的电子处于半充满状态,第一电离能大于O,元素的第一电离能由大到小的顺序为N>O>C;
(2)①H2O、CO2、NH3三种分子中,中心原子的价层电子对数分别为![]() 4个、
4个、![]() 2个、
2个、![]() 4个,其中水分子含有2对孤电子对,所以水分子是V形分子;
4个,其中水分子含有2对孤电子对,所以水分子是V形分子;
②CO2是非极性分子而水是极性分子,故CO2在水中溶解度较小,NH3是极性分子且能与水分子形成分子间氢键,故NH3在水中溶解度很大;
(3)Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,根据相似相溶原理可知该物质应为极性分子;Cu(NH3)2Cl2有两种同分异构体,参考甲烷的二氯代物只有一种,可知[Cu(NH3)4]2+的空间构型应为平面正方形;
(4)①判断固体是晶体还是非晶体最可靠的方法是X-射线衍射法。
②离子晶体熔点较高,由离子构成,含有离子键;而许多分子晶体也可溶于水,故c项符合题意;
(5)由图及均摊原理知,晶胞中氧离子数是![]() ,钠离子的数目是8,故化学式为Na2O;一个晶胞中含有4个“Na2O”组成微粒,则晶胞的质量为
,钠离子的数目是8,故化学式为Na2O;一个晶胞中含有4个“Na2O”组成微粒,则晶胞的质量为![]() ,晶胞的体积为d3
,晶胞的体积为d3![]() 10-30 cm3,则晶胞的密度
10-30 cm3,则晶胞的密度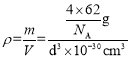 ,解得
,解得![]()

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案