题目内容
【题目】锰单质及其化合物应用十分广泛。回答下列问题:
(1)Mn在元素周期表中的位置为__,基态Mn原子的价电子排布式为__。
(2)MnCl2可与NH3反应生成[Mn(NH3)6]Cl2,新生成的化学键为__键。NH3分子的空间构型为__,其中N原子的杂化轨道类型为__。
(3)金属锰有多种晶型,其中δMn的结构为体心立方堆积,晶胞参数为αpm。δMn中锰的原子半径为__pm。已知阿伏加德罗常数的值为NA,δMn的理论密度ρ=__gcm3。(列出计算式)
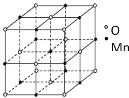
(4)已知锰的某种氧化物的晶胞如图所示,该氧化物的化学式为__,锰离子的配位数为__。
【答案】第四周期第ⅦB族 3d54S2 配位键 三角锥形 sp3 ![]()
![]() MnO 6
MnO 6
【解析】
(1)Mn是25号元素,根据能量最低原理书写基态Mn原子的价电子排布式;
(2)MnCl2与NH3通过配位键结合为[Mn(NH3)6]Cl2。NH3分子中N原子价电子对数是4,有1对孤电子对;
(3)体心立方堆积,体对角线=4r;
(4)根据均摊原则计算该氧化物的化学式。
(1) Mn是25号元素,在元素周期表中的位置是第四周期第ⅦB族;根据能量最低原理,基态Mn原子的价电子排布式是3d54S2;
(2)MnCl2与NH3通过配位键结合为[Mn(NH3)6]Cl2,新生成的化学键为配位键。NH3分子中N原子价电子对数是4,有1对孤电子对,NH3分子的空间构型为三角锥形;其中N原子的杂化轨道类型为sp3。
(3)δMn的结构为体心立方堆积,晶胞参数为αpm,则晶胞的体对角线=![]() pm,体对角线=4r,δMn中锰的原子半径为
pm,体对角线=4r,δMn中锰的原子半径为![]() pm。δMn的1个晶胞含有Mn原子数
pm。δMn的1个晶胞含有Mn原子数![]() ,密度ρ=
,密度ρ=![]() gcm3。
gcm3。
(4)根据均摊原则,该晶胞含有氧离子数是![]() 、Mn离子数是
、Mn离子数是![]() ,该氧化物的化学式为MnO,锰离子周围有6个距离最近且相等的氧离子,锰离子的配位数为6。
,该氧化物的化学式为MnO,锰离子周围有6个距离最近且相等的氧离子,锰离子的配位数为6。