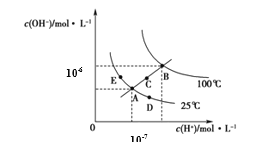
题目内容
【题目】化学与生活、环境密切相关,下列说法错误的是
A.生活中钢铁制品生锈主要是由于发生吸氧腐蚀所致
B.石油的裂化、裂解和煤的干馏都属于化学变化
C.焚烧废旧塑料可有效防止“白色污染”
D.工业废水中的![]() 、
、![]() 等重金属阳离子可以通过加入
等重金属阳离子可以通过加入![]() 除去
除去
【答案】C
【解析】
A.生活中钢铁制品生锈主要是由于钢铁及其中含有碳及周围的水膜构成原电池,发生吸氧腐蚀所致,A正确;
B.石油的裂化、裂解和煤的干馏都有新物质产生,因此都属于化学变化,B正确;
C.焚烧废旧塑料可以减少“白色污染”,但不能防止“白色污染”,同时,焚烧废旧塑料造成环境二次污染,C错误;
D.工业废水中的Cu2+、Hg2+等重金属阳离子可以通过加入FeS,发生沉淀转化,使Cu2+、Hg2+等重金属阳离子形成更难溶于水的CuS、HgS而除去,D正确。
答案选C。

【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,不溶于水,易溶于醇等有机溶剂。实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O CH2=CH2+Br2→BrCH2CH2Br
CH2=CH2+H2O CH2=CH2+Br2→BrCH2CH2Br
已知:①乙醇在浓硫酸存在下在140℃脱水生成乙醚2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
②实验中常因温度过高而使乙醇和浓硫酸反应生成少量SO2和CO2,用12.0g溴和足量的乙醇制备1,2-二溴乙烷,实验装置如图所示:
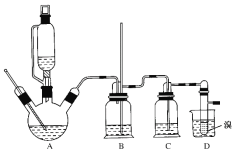
有关数据列表如下:
类别 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,A中按最佳体积比3﹕1加入乙醇与浓硫酸后,A中还要加入几粒碎瓷片,其作用是________。要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是________。
(2)装置B的作用是作安全瓶,瓶中盛水,除了可以防止倒吸以外,还可判断装置是否堵塞,若堵塞,B中现象是____________。
(3)在装置C中应加入NaOH溶液,其目的是_________。
(4)装置D中小试管内盛有液溴,判断该制备反应已经结束的最简单方法是_______。
(5)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在__________层(填“上”或“下”)。若产物中有少量未反应的Br2,最好用______洗涤除去;若产物中有少量副产物乙醚,可用_____(填操作方法名称)的方法除去。
(6)若实验结束后得到9.4g产品,1,2—二溴乙烷的产率为___________。