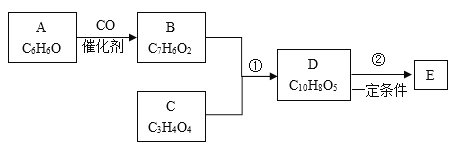
题目内容
【题目】(1)在热的稀硫酸中溶解了11.4g FeSO4固体,加入足量 KNO3溶液,使Fe2+全部转化成Fe3+,并放出NO气体。
①反应中氧化产物是(填化学式)______,FeSO4恰好完全反应时,转移电子的物质的量是_____。
②配平该反应的方程式:
____FeSO4+____KNO3+____H2SO4=_____K2SO4+____Fe2(SO4)3+____NO↑+____H2O
③用单线桥法表示下面反应中的电子转移方向和数目:_________________
2Mg+CO2![]() 2MgO+C。
2MgO+C。
(2)硫代硫酸钠可用作脱氯剂,已知25.0mL0.10mol/L Na2S2O3溶液恰好把标准状况下112mLCl2完全转化为Cl-,则S2O32-将转化成______________
【答案】Fe2(SO4)3 0.075mol 6 2 4 1 3 2 4 ![]() SO32-
SO32-
【解析】
(1)①根据元素化合价升高的反应物是还原剂,其对应产物为氧化产物;FeSO4~Fe2+~Fe3+~e-,转移电子n(e-)=n(FeSO4),据此计算;
②根据化合价升降总数相等和质量守恒来配平方程式;
③单线桥的箭头始于反应物中失去电子的元素,箭头指向反应物中得到电子的元素,在桥上标明电子的得失电子数目。
(2)根据反应中Na2S2O3失去电子,Cl2中的Cl原子得到电子,反应过程中电子转移数目等于元素化合价升降数目分析。
(1)①在反应中FeSO4中铁元素的化合价由+2价升高为+3价,作还原剂,所以对应的产物Fe2(SO4)3是氧化产物,11.4g FeSO4固体的物质的量n(FeSO4)=![]() =0.075mol,由FeSO4~Fe2+~Fe3+~e-,可知转移电子的物质的量n(e-)=n(FeSO4)=0.075mol;
=0.075mol,由FeSO4~Fe2+~Fe3+~e-,可知转移电子的物质的量n(e-)=n(FeSO4)=0.075mol;
②在反应中FeSO4中铁的化合价由+2价升高为+3价,变化1,KNO3中氮的化合价由+5价降低为+2价,变化3,根据化合价升降总数相等和质量守恒来配平方程式:6FeSO4+2KNO3+4H2SO4= K2SO4+3Fe2(SO4)3+2NO↑+4H2O;
③在反应2Mg+CO2![]() 2MgO+C中,Mg失去电子,CO2中的C得到电子,反应过程中电子转移数目为2×2e- ,用单线桥表示为
2MgO+C中,Mg失去电子,CO2中的C得到电子,反应过程中电子转移数目为2×2e- ,用单线桥表示为![]() ;
;
(2)n(Cl2)=![]() =0.005mol,反应过程中假设反应后S元素化合价为+x价,根据元素化合价升降总数相等可知:0.005×2=0.10mol/L×0.025L×2(x-2),解得x=+4价,所以反应后Na2S2O3将转化成Na2SO3,即含有S元素的离子为SO32-。
=0.005mol,反应过程中假设反应后S元素化合价为+x价,根据元素化合价升降总数相等可知:0.005×2=0.10mol/L×0.025L×2(x-2),解得x=+4价,所以反应后Na2S2O3将转化成Na2SO3,即含有S元素的离子为SO32-。

 名校课堂系列答案
名校课堂系列答案