��Ŀ����
����Ŀ��̼��þ������һ�������������β����е���ǿ����ij������MgCl2(����������FeCl2��FeCl3)Ϊԭ���Ʊ�̼��þ���루MgCO3��H2O���Ĺ����������£�

��֪��Fe3+��Fe2+��Mg2+���������������ʱ��pH
���� | ��ʼ���� | ������ȫ |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mg(OH)2 | 9.9 | 11.1 |
ע��Fe(OH)2��������״�����״���Һ�г�ȥ��
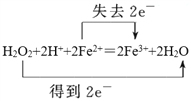
��1��д���������������з��������ӷ�Ӧ����ʽ����˫���ű������ת�Ƶķ������Ŀ____��
��2��pH���ڵķ�Χ______����������Ҫ�ɷ�______���ѧʽ����
��3������X�������ˡ�ϴ�ӡ���ɣ�֤��̼��þ�����Ѿ�ϴ�Ӹɾ��ķ���_____��
��4��ˮ������Һ��Fe2+��Fe3+�����IJⶨ
��ȡˮ������Һ100.00 mL�����Cl��Ũ��Ϊ0.455 mol��L1�������л���ͨ������ʹFe2+ǡ����ȫת��ΪFe3+����ô�ʱ��Һ��Cl��Ũ��Ϊ0.460 mol��L1����Һ����仯���Բ��ƣ���
����ȡˮ������Һ100.00 mL�������м��������1 mol��L1 NaOH��Һ����ַ�Ӧ����ˡ�ϴ�ӡ����գ���ȴ�Ƶù����ĩ������Ϊ0.96 g��
��ͨ������ȷ��ˮ������Һ��Fe2+��Fe3+�����ʵ���Ũ��______��д��������̣���
���𰸡� 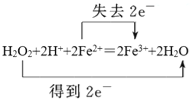 3.7~9.9 Fe(OH)3 ȡ�������һ��ϴ��Һ�������м��������ữ��AgNO3��Һ�����ް�ɫ����������֤����ϴ�Ӹɾ�������NH4+���۷֣� �ɹ�ϵʽ��2Fe2+~ Cl2~ 2Cl����֪�����ӵ�Cl-�����ʵ�����ΪFe2+�����ʵ���n(Fe2+) =100��10-3��(0.460-0.455)=5.0��10-4mol
3.7~9.9 Fe(OH)3 ȡ�������һ��ϴ��Һ�������м��������ữ��AgNO3��Һ�����ް�ɫ����������֤����ϴ�Ӹɾ�������NH4+���۷֣� �ɹ�ϵʽ��2Fe2+~ Cl2~ 2Cl����֪�����ӵ�Cl-�����ʵ�����ΪFe2+�����ʵ���n(Fe2+) =100��10-3��(0.460-0.455)=5.0��10-4mol
c(Fe2+)=5.0��10-4��100��10-3=0.005 mol��L1
����ijɷ�ΪFe2O3��MgO
��[n(Fe3+)+ n(Fe2+)]��0.5��160+ n(Mg2+)��40=0.96
������Һ�еĵ���غ���3n(Fe3+)+ 2n(Fe2+)+2n(Mg2+)=0.455��100��10-3
��n(Fe3+)=1.5��10-3mol
��c(Fe3+)=0.015 mol��L1
��������ԭ��ˮ������������⣬��������������Ϊ�����ӣ��ٵ���pH��ʹ������ת��Ϊ������������ȥ�����˺���Һ�м��백ˮ��̼����淋õ��������ٹ��ˡ�ϴ�ӡ���ɵõ�̼��þ���롣��
��1���������̷�����Ӧ��H2O2+2H++2Fe2+��2Fe3++2H2O����˫���ű������ת�Ƶķ������ĿΪ
 ����2��������pH��Ŀ����ʹFe3+����������������������������ȥ���Ҿ�������Mg2+ת��Ϊ���������ݸ���������������ɵ�pH�������ȫ��pH��֪Ӧ����pH��3.7��9.9֮�䣬��������Ҫ�ɷ�ΪFe(OH)3����3��̼��þ�������ḽ�������ӵȣ����Լ�������Ƿ�ϴ�Ӹɾ���ʵ�������ȡ�������һ��ϴ��Һ�������м��������ữ��AgNO3��Һ�����ް�ɫ����������֤����ϴ�Ӹɾ�����4�����ݷ�Ӧ�ķ���ʽ�ɵù�ϵʽ��2Fe2+~Cl2~2Cl�����ӵ�Cl�������ʵ�����ΪFe2+�����ʵ���n(Fe2+) =0.1L��(0.460-0.455)mol/L=5.0��10-4mol��c(Fe2+)=5.0��10-4mol��0.1L=0.005mol��L1������ijɷ�ΪFe2O3��MgO����[n(Fe3+)+n(Fe2+)]��0.5��160+n(Mg2+)��40=0.96��������Һ�еĵ���غ��֪��3n(Fe3+)+2n(Fe2+)+2n(Mg2+)=0.455mol/L��0.1L�����n(Fe3+)=1.5��10-3mol����c(Fe3+)=0.015 mol��L1��
����2��������pH��Ŀ����ʹFe3+����������������������������ȥ���Ҿ�������Mg2+ת��Ϊ���������ݸ���������������ɵ�pH�������ȫ��pH��֪Ӧ����pH��3.7��9.9֮�䣬��������Ҫ�ɷ�ΪFe(OH)3����3��̼��þ�������ḽ�������ӵȣ����Լ�������Ƿ�ϴ�Ӹɾ���ʵ�������ȡ�������һ��ϴ��Һ�������м��������ữ��AgNO3��Һ�����ް�ɫ����������֤����ϴ�Ӹɾ�����4�����ݷ�Ӧ�ķ���ʽ�ɵù�ϵʽ��2Fe2+~Cl2~2Cl�����ӵ�Cl�������ʵ�����ΪFe2+�����ʵ���n(Fe2+) =0.1L��(0.460-0.455)mol/L=5.0��10-4mol��c(Fe2+)=5.0��10-4mol��0.1L=0.005mol��L1������ijɷ�ΪFe2O3��MgO����[n(Fe3+)+n(Fe2+)]��0.5��160+n(Mg2+)��40=0.96��������Һ�еĵ���غ��֪��3n(Fe3+)+2n(Fe2+)+2n(Mg2+)=0.455mol/L��0.1L�����n(Fe3+)=1.5��10-3mol����c(Fe3+)=0.015 mol��L1��

 ����ѧ��ţ��Ӣ��ϵ�д�
����ѧ��ţ��Ӣ��ϵ�д� ��ѧ�̸̳����¿α�ϵ�д�
��ѧ�̸̳����¿α�ϵ�д�