题目内容
某化学兴趣小组为探索铜与浓硫酸的反应,用如图所示装置进行有关实验。
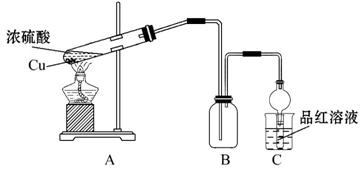
甲小组取ag铜片和一定量的浓硫酸放入试管中加热,直到反应完毕,最后发现试管中还有一定量的H2SO4和铜剩余。
(1)写出装置A中所发生反应的化学方程式____________________________。
(2)若用含0.2 mol H2SO4的浓硫酸与过量铜片共热,能否收集到0.1 mol SO2?________(填“能”或“不能”)。
(3)当集气瓶B中的气体收集满时,装置C中有可能观察到的现象是_________
_______________________________________________________________。
(4)为什么有一定量的余酸却未能使Cu完全溶解,你认为原因是_____ _____
_____ __
__
________________________________________________________________。
(5)乙组同学认为:实验装置C有可能造成环境污染,乙组学生设计了最简单方法给予解决:在C试管口塞上一团沾有________溶液的棉花。
(6)为了证明反应结束后的试管中的确有剩余的稀硫酸,可选择的试剂是________。
A.铁粉 B.Na2CO3溶液 C.BaCl2溶液
.【解析】铜只能与浓硫酸反应,与稀硫酸不反应;二氧化硫可以使品红溶液褪色,可以用氢氧化钠溶液吸收,为防止污染,在试管口用浸有氢氧化钠溶液的棉花团堵住;证明剩余稀硫酸应检验其中的H+。
 答案:(1)Cu+2H2SO4(浓)
答案:(1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)不能 (3)品红溶液褪色
(4)稀硫酸不能与Cu反应
(5)NaOH (6)A、B

练习册系列答案
相关题目
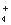
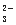 +2H+=H2O+CO2↑
+2H+=H2O+CO2↑