题目内容
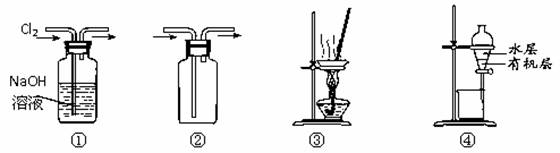
铝合金在日常生活中有广泛应用。某同学设计如下方案测定铝合金样品中铝元素的质量分数:
方案Ⅰ 取W g样品溶于足量稀硫酸,收集并测定气体体积为a mL(折合成标准状况下体积),计算样品纯度。
方案Ⅱ 取W g样品溶于足量稀盐酸,过滤,在滤液中加入过量的氨水,再过滤、洗涤、烘干、灼烧和称重得c g固体。
(1)写出方案Ⅱ中发生反应的离子方程式或化学方程式:_______________________
__________________。
(2)利用方案Ⅰ的数据计算样品纯度为______________________________________。
(3)请你对上述两种方案的测定结果进行评价,完成下表。
| 方案 | 评价(准确、不 准确或不确定) | 简述理由 |
| Ⅰ | ||
| Ⅱ |
(1)2Al+6H+===2Al3++3H2↑,Al3++3NH3·H2O===Al(OH)3↓+3NH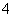 ,2Al(OH)3
,2Al(OH)3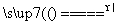 Al2O3+3H2O
Al2O3+3H2O
(2)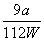 %
%
(3)
| 方 案 | 评价(准 确、不准确 或不确定) | 简述理由 |
| Ⅰ | 不确定 | 若样品含有不反应的杂质,该结果准确;若含有镁、铁等与稀硫酸反应产生氢气的杂质,测定结果偏高;若样品含有氧化铝等与酸反应不产生气体的杂质,测定结果偏低 |
| Ⅱ | 不确定 | 若样品含有铜等不反应的杂质,结果准确;若含有镁、铁等杂质,产生氧化镁和氧化铁固体,测定结果偏高 |

练习册系列答案
相关题目
 _____
_____ __
__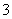 、Ba2+、Cl-
、Ba2+、Cl-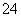 、Al3+、Cu2+
、Al3+、Cu2+