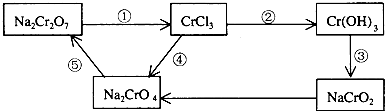
题目内容
7.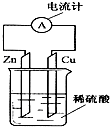 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )| A. | 电流从铜片经导线流向锌片 | B. | 该装置将电能转变为化学能 | ||
| C. | 一段时间后,铜片质量减轻 | D. | 锌片发生还原反应 |
分析 该装置能自发的进行氧化还原反应,所以能构成原电池,锌易失电子发生氧化反应而作负极,铜作正极,电子从负极沿导线流向正极,电流流向与此相反,据此分析解答.
解答 解:Zn能够与稀硫酸反应,所以能构成原电池,化学能转化为电能,锌易失电子发生氧化反应而作负极,铜作正极,氢离子在Cu电极上得电子生成氢气,Cu质量不变,电流从正极Cu沿导线流向负极Zn,故选A.
点评 本题考查了原电池原理,明确原电池的判断方法、正负极的判断、正负极上发生的反应即可解答,难度不大.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
18.某氖原子的质量是a g,12C原子的质量是bg用NA表示阿伏加德罗常数,则以下叙述中错误的是( )
| A. | 该氖原子的相对原子质量为12a/b | |
| B. | Wg该氖原子的物质的量为W/aNA mol | |
| C. | Wg 该氖原子所含的质子数为 10W/a个 | |
| D. | 氖元素的摩尔质量为aNA g/mol |
15.已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,将1mol N2和3mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量(忽略能量损失)( )
| A. | 一定大于92.4 kJ | B. | 一定小于92.4 kJ | C. | 一定等于92.4 kJ | D. | 无法确定 |
16.体积均为100mL,浓度均为1mol.L-1的盐酸和硫酸溶液,分别加入质量相等的镁块充分反应,所生成的气体在相同条件下体积比为2:3,则镁块的质量为( )
| A. | 1.8 g | B. | 2.4g | C. | 3.6g | D. | 4.8g |
17.下列有关除杂质(括号内物质为杂质)的方法中,错误的是( )
| A. | 乙醇(水):加足量金属钠后,再蒸馏 | |
| B. | NaHCO3溶液(少量Na2CO3):通入足量的CO2气体 | |
| C. | 苯(混有Br2):加NaOH溶液洗涤、静置、分液 | |
| D. | FeCl3溶液(FeCl2):通入适量氯气 |