题目内容
17.化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质.例如: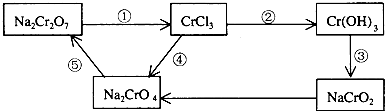
(l)在上述有编号的步骤中,需用还原剂的是①,需用氧化剂的是④(填编号).
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是Cr(OH)3(填化学式).
(3)已知在稀盐酸酸化条件下1molNa2Cr2O7能氧化KI生成3molI2,则还原产物为CrCl3(填化学式).
分析 反应中①Cr元素化合价降低,②③Cr元素化合价不变,④Cr元素化合价升高,⑤Cr元素化合价不变,并结合物质的性质、氧化还原反应中电子守恒来解答.
解答 解:(1)反应中①Cr元素化合价降低,需要加还原剂;④Cr元素化合价升高,需要加氧化剂,故答案为:①;④;
(2)②③Cr元素化合价不变,均为酸碱之间的反应,由③的反应及氢氧化铝的两性,可知上述循环中,既能与强酸反应又能与强碱反应的两性物质是Cr(OH)3,
故答案为:Cr(OH)3;
(3)设还原产物中Cr元素的化合价为x,由电子守恒可知,1mol×2×(6-x)=3mol×2×(1-0),解得x=+3,即还原产物为CrCl3,故答案为:CrCl3.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中Cr元素的化合价变化及电子守恒为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
4.下列叙述中,正确的是( )
| A. | 同物质的量的NaCl和Cl2含有的分子数相等 | |
| B. | SO42-的摩尔质量是96g | |
| C. | 阿伏伽德罗常数约为6.02×1023mol-1 | |
| D. | 1摩尔氧气的质量等于NA个O2分子的相对分子质量 |
5.下列说法正确的是( )
| A. | 液态 HCl、固体NaCl 均不导电,所以 HCl、NaCl 均是非电解质 | |
| B. | NH3、CO2的水溶液均导电,所以 NH3、CO2 均是电解质 | |
| C. | 铜、石墨均导电,所以它们是电解质 | |
| D. | 蔗糖、酒精在水溶液或熔化时均不导电,所以它们是非电解质 |
12.下列实验操作、现象和发生的离子反应完全正确的是( )
| 实验操作 | 现象 | 发生的离子反应 | |
| A | 向BaCl2 溶液中通入CO2 | 溶液浑浊 | Ba2++CO2+H2O═BaCO3↓+2H+ |
| B | 向NaAlO2溶液中滴加过量CO2 | 溶液浑浊 | AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
| D | 将Cl2通入KI溶液中,加入CCl4,振荡,静置 | 上层溶液显紫红色 | Cl2+2I-═2Cl-+I2 |
| A. | A | B. | B | C. | C | D. | D |
2.想一想:盐酸、75%的酒精溶液、氯水这些物质为什么归为一类,下列哪些物质还可以和他们归为一类( )
| A. | H2SO4 | B. | 胆矾 | C. | Fe(OH)3胶体 | D. | 液氯 |
9.下列符合实际并用于工业生产的是( )
| A. | 电解氯化钠水溶液来制金属钠 | B. | 氢气和氯气混合后光照制氯化氢 | ||
| C. | 金属钠在氯气中燃烧制氯化钠 | D. | 氯气和石灰乳作用制漂白粉 |
6.下列各组物质按酸、碱、盐分类顺序排列正确的是( )
| A. | 盐酸、纯碱、石膏 | B. | 硫酸、烧碱、绿矾 | ||
| C. | 碳酸、乙醇、醋酸钠 | D. | 磷酸、熟石灰、可性钾 |
7.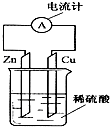 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )
 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )| A. | 电流从铜片经导线流向锌片 | B. | 该装置将电能转变为化学能 | ||
| C. | 一段时间后,铜片质量减轻 | D. | 锌片发生还原反应 |