题目内容
2.反应2A?B+C,在某一温度时,达到平衡.(1)若增加B物质的量,平衡不移动,则B为固体或纯液态
(2)若温度升高,A的转化率变小,则正反应是放热反应
(3)若A是气态物质,加压时,平衡不移动,则B为气态,C为气态
(4)加入正催化剂,正、逆反应的速率都增大(“增大”、“减小”或“不变”)且倍数相同(“相同”或“不同”)故平衡不移动.
分析 (1)增大B的量平衡不移动,说明B不是气态;
(2)升温A的转化率减小,说明平衡逆向移动;
(3)若A是气态物质,加压时,平衡不移动,说明反应前后气态物质的量相同;
(4)加入催化剂正逆反应速率相同程度地增大,平衡不移动.
解答 解:(1)增大B的量平衡不移动,说明B不是气态,B为固体或纯液体,故答案为:固体或纯液体;
(2)升温A的转化率减小,说明平衡逆向移动,正反应放热,故答案为:放;
(3)若A是气态物质,加压时,平衡不移动,说明反应前后气态物质的量相同,据BC的化学计量数可知BC都是气体,故答案为:气;气;
(4)加入催化剂正逆反应速率相同程度地增大,平衡不移动故答案为:增大;相同.
点评 本题考查了化学平衡的影响因素、影响化学反应速率的因素,难度不大,注意压强对平衡移动的影响.

练习册系列答案
相关题目
12.下列实验操作、现象和发生的离子反应完全正确的是( )
| 实验操作 | 现象 | 发生的离子反应 | |
| A | 向BaCl2 溶液中通入CO2 | 溶液浑浊 | Ba2++CO2+H2O═BaCO3↓+2H+ |
| B | 向NaAlO2溶液中滴加过量CO2 | 溶液浑浊 | AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
| D | 将Cl2通入KI溶液中,加入CCl4,振荡,静置 | 上层溶液显紫红色 | Cl2+2I-═2Cl-+I2 |
| A. | A | B. | B | C. | C | D. | D |
10.澄清透明的溶液中能大量共存的是( )
| A. | Cu2+、C1-、SO42-、K+ | B. | K+、OH-、CO32-、Fe2+ | ||
| C. | Ca2+、OH-、C1-、Na+ | D. | Ag+、NO3-、Cl-、K+ |
17.一定温度下,在固定体积的密闭容器中进行下列反应
4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
| A. | 若单位时间内生成xmolNO的同时消耗x molNH3,则反应达到平衡状态 | |
| B. | 当混合气体的压强不再改变,则说明反应已达到平衡状态 | |
| C. | 当混合气体的密度不再改变,则说明反应已达到平衡状态 | |
| D. | 达到化学平衡后,若增大容器容积,正反应速率减小,逆反应速率增大 |
7.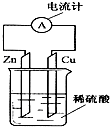 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )
 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )| A. | 电流从铜片经导线流向锌片 | B. | 该装置将电能转变为化学能 | ||
| C. | 一段时间后,铜片质量减轻 | D. | 锌片发生还原反应 |
11.下列实验操作或结论正确的是( )
| A. | 在某溶液中加入AgN03溶液有白色沉淀产生,再加盐酸,沉淀不消失,则该溶液中一定有CI- | |
| B. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有C032- | |
| C. | 做焰色反应前应先将铂丝在稀硫酸中洗干净再蘸取待测液进行实验 | |
| D. | 如透过蓝色的钴玻璃能够观察到紫色火焰,则肯定有K元素,可能有Na元素 |
12.设NA为阿伏伽德罗常数的数值,下列说法中正确的是( )
| A. | 46 g乙醇中含有的化学键数为7NA | |
| B. | 1 mol OH-和1 mol-OH含有的电子数均为10NA | |
| C. | 标准状况下,6.72 L NO2和水充分反应转移电子数为0.2NA | |
| D. | 常温常压下,28 g 乙烯分子中共含有2NA对共用电子对 |
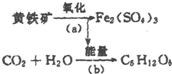 “细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石.例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:
“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石.例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图: