题目内容
【题目】(1)分别按如图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸。请回答下列问题:

①以下叙述中,正确的是__(填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两装置中铜片表面均有气泡产生
C.装置乙中存在“化学能→电能→光能”的转化
D.乙的外电路中电流方向Zn→Cu
E.如果将装置乙中锌片换成铁片,则电路中的电流方向不变
F.乙溶液中SO42-向铜片方向移动
②在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是___。
③在乙实验中,如果把硫酸换成硫酸铜溶液,当负极材料消耗的质量为2.6g时,则电路中转移电子数为___。
(2)某种燃料电池的工作原理示意如图所示,a、b均为惰性电极。
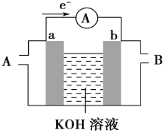
①电池工作时,空气从__口通入(填“A”或“B”);
②若使用的燃料为甲醇(CH3OH),a极的电极反应式为__。
【答案】CE 锌片不纯,在锌片上就形成原电池 0.08NA B CH3OH-6e-+8OH-=CO32-+6H2O
【解析】
(1)①原电池的构成条件是:1.有两个活泼性不同的电极;2.将电极插入电解质溶液中;3.两电极间构成闭合回路;4.能自发的进行氧化还原反应。形成原电池加快反应速率,并且电流方向为正极到负极,离子移动阴离子移向阴极,据此分析判断;
②原电池正极上氢离子放电生成氢气,则锌片有气泡产生说明锌片不纯,据此分析;
③通过电子的得失守恒计算转移电子数;
(2)由装置图中的电子流向可知,a失去电子为负极通燃料,b得到电子为正极通空气,以此分析。
(1)①A.甲不能构成原电池,只有锌和稀硫酸发生氧化还原反应,乙池中能构成原电池,锌作负极,铜作正极,故A错误;
B. 甲池中不能构成原电池,所以甲池中铜电极上没有气泡产生,故B错误;
C. 装置乙中存在“化学能→电能→光能”的转化,故C正确;
D. 乙的外电路中电流方向由正极到负极Cu→Zn,故D错误;
E. 如果将装置乙中锌片换成铁片,形成Fe-Cu原电池,电流方向为Cu→Fe方向不变,故E正确;
F. 乙溶液中SO42-向负极Zn片方向移动,故F错误;
故答案选CE;
②锌片有气泡产生说明锌片不纯,锌和锌片中的杂质构成原电池,杂质作正极,氢离子在杂质上得电子生成氢气,故答案为:锌片不纯,在锌片上就形成原电池;故答案为:锌片不纯,在锌片上就形成原电池;
③在乙实验中,如果把硫酸换成硫酸铜溶液,当负极材料消耗的质量为2.6g时,由电极方程式![]() ,可知消耗Zn的物质的量为
,可知消耗Zn的物质的量为![]() ,则转移电子数为0.08NA,故答案为:0.08NA;
,则转移电子数为0.08NA,故答案为:0.08NA;
(2)①由装置图中的电子流向可知,a失去电子为负极通燃料,b得到电子为正极通空气,电池工作时,空气从B口通入,故答案为:B。
②若使用的燃料为甲醇(CH3OH),a极的电极反应式为![]() ,故答案为:
,故答案为:![]() 。
。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案






