题目内容
【题目】对下列实验的描述正确的是

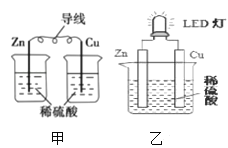
A. 图甲所示的实验:根据溶液颜色变化可比较Zn、Cu的金属活动性
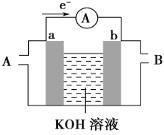
B. 图乙所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀
C. 图丙所示的实验:根据温度计读数的变化用浓硫酸和NaOH反应测定中和热
D. 图丁所示的实验:根据两烧瓶中气体颜色的变化判断2NO2(g)N2O4(g)是吸热反应
【答案】A
【解析】
A.Cu、Zn原电池中,活泼金属为负极,若溶液的蓝色逐渐变浅,说明锌作负极、锌溶解变为锌离子进入溶液,溶液中的铜离子在正极上得电子析出铜,故溶液中的铜离子浓度逐渐减小,故根据溶液的颜色变化可以比较Cu和Zn的金属活动性,A正确;
B.析氢腐蚀生成氢气,而吸氧腐蚀中要消耗氧气。由于导管内液面上升,说明有氧气消耗,故发生了吸氧腐蚀,B错误;
C.中和滴定应选稀的强酸,不能利用浓硫酸测定中和热,故C错误;
D.热水中颜色深,则逆反应为吸热反应,所以正反应为放热反应,故D错误。
故选A。

 新思维假期作业暑假吉林大学出版社系列答案
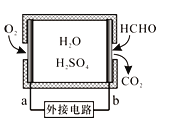
新思维假期作业暑假吉林大学出版社系列答案【题目】亚硝酸氯(ClNO)是有机合成中的重要试剂。亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K1
2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K2
NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g)![]() 2ClNO(g) K3
2ClNO(g) K3
则K1、K2、K3之间的关系为K3=____________。
(2)T℃时,2NO(g)+Cl2(g)![]() 2ClNO(g)的正反应速率表达式为υ正=kcn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为υ正=kcn(ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/mol·L-1 | υ/mol·L-1· s-1 |
① | 0.30 | 3.6×10-8 |
② | 0.60 | 1.44×10-7 |
③ | 0.90 | 3.24×10-7 |
n=__________;k=___________(注明单位)。
(3)在2 L的恒容密闭容器中充入4 mol NO(g)和2molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图I。
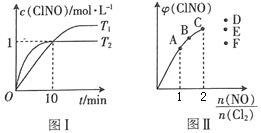
① 温度为T1时,能作为该反应达到平衡的标志的有__________。
a.气体体积保持不变 b.容器压强保持不变 c.平衡常数K保持不变
d.气体颜色保持不变 e.υ(ClNO)=υ(NO) f.NO与ClNO的物质的量比值保持不变
② 反应开始到10min时,Cl2的平均反应速率υ(Cl2)=_______________。
③ 温度为T2时,10 min时反应已经达到平衡,该反应的平衡常数K=____________。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ随![]() 的变化如图II,则A、B、C三个状态中,NO的转化率最小的是____点,当
的变化如图II,则A、B、C三个状态中,NO的转化率最小的是____点,当![]() 时,达到平衡状态时ClNO的体积分数φ可能是D、E、F三点中的_____点。
时,达到平衡状态时ClNO的体积分数φ可能是D、E、F三点中的_____点。