题目内容
【题目】在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH ![]() CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
(1)25 ℃时,浓度均为0.1mol/L的盐酸和醋酸溶液,下列说法正确的是___________;
①两溶液的pH相同
②两溶液的导电能力相同
③由水电离出的c(OH-)相同
④中和等物质的量的NaOH溶液,消耗两溶液的体积相同
(2)25℃时,pH =5的稀醋酸溶液中,由水电离的c(OH-)=____________mol·L-1 ,c(CH3COO-)=_____________mol·L-1 (填数字表达式);
(3)25 ℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水量的增多,两溶液pH的变化如图所示,则符合盐酸pH变化的曲线是_______________;

(4)25 ℃时,向体积为Va mLpH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与的Vb关系是Va________________Vb(填“>”、“<”或“=”)。
(5)25 ℃时,若向氨水中加入稀盐酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(Cl-)=________ mol/L。
【答案】④ 10-9mol/L 10-5-10-9mol/L Ⅰ < amol/L
【解析】
(1)①CH3COOH是弱电解质,HCl是强电解质,等浓度的两种溶液中盐酸中c(H+)大于CH3COOH中c(H+),据此进行解答;
②溶液的导电能力与离子浓度成正比;
③酸抑制水电离,酸中氢离子浓度越大,其抑制程度越大;
④中和等物质的量的NaOH溶液,消耗酸的体积与酸的浓度成反比;
(2)根据醋酸的电离平衡CH3COOH ![]() CH3COO-+H+ 和电荷守恒来计算;
CH3COO-+H+ 和电荷守恒来计算;
(3)pH相等的醋酸和盐酸中,加水稀释促进醋酸电离,导致稀释相同的倍数时,醋酸的pH小于HCl;
(4)混合溶液呈中性,则c(H+)=c(OH-),醋酸钠是强碱弱酸盐,其溶液呈碱性,要使混合溶液呈中性,则醋酸应该稍微过量;
(5)25℃时,若向氨水中加入稀盐酸至溶液的pH=7,溶液呈中性说明氢离子和氢氧根的浓度一定相等,根据电荷守恒来判断离子浓度大小。
(1)① CH3COOH是弱电解质,HCl是强电解质,等浓度的两种溶液中盐酸中c(H+)大于CH3COOH中c(H+),所以醋酸的pH大于HCl,故①错误;
②CH3COOH是弱电解质,HCl是强电解质,等浓度的两种溶液中盐酸中离子浓度大于醋酸,溶液的导电能力与离子浓度成正比,所以HCl溶液的导电能力强,故②错误;
③酸抑制水电离,酸中氢离子浓度越大,其抑制程度越大,等浓度的两种酸中,HCl中氢离子浓度大于醋酸,所以由水电离出的c(OH-)醋酸大于盐酸,故③错误;
④中和等物质的量的NaOH溶液,消耗酸的体积与酸的浓度成反比,两种酸的物质的量浓度相等,所以需要酸的体积相等,故④正确;
因此,本题正确答案是:④。
(2)在 pH=5的稀醋酸溶液中, c(H+)=10-5mol/L,则c(OH-)=10-9mol/L,根据醋酸溶液中电荷守恒可以知道: c(H+)=c(OH-)+c(CH3COO-),可以看出 c(CH3COO-)= c(H+)- c(OH-)= 10-5-10-9mol/L;
因此,本题正确答案是: 10-9mol/L ,10-5-10-9mol/L。
(3)pH相等的醋酸和盐酸中,加水稀释促进醋酸电离,导致稀释相同的倍数时,醋酸的pH小于HCl,根据图象知,Ⅰ是HCl变化曲线,
因此,本题正确答案是:Ⅰ。
(4)醋酸溶液是弱酸,pH为3的醋酸溶液中,醋酸的浓度大于10-3mol/L, pH=11的NaOH溶液浓度等于10-3mol/L,最后溶液恰好呈中性,则氢氧化钠溶液的体积稍大些,即: Va<Vb;因此,本题正确答案是: <。
(5)混合溶液呈中性,则c(H+)=c(OH-),再根据电荷守恒c(NH4+)+c(H+)=c(OH-)+ c(Cl-)可以知道: c(NH4+)=c(Cl-)= amol/L;
因此,本题正确答案是: amol/L。

 阅读快车系列答案
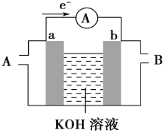
阅读快车系列答案【题目】X、Y两根金属棒插入Z溶液中构成如图所示装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是下列中的( )

编号 | X | Y | Z |
A | Zn | Cu | 稀硫酸 |
B | Ag | Zn | 硝酸银溶液 |
C | Cu | Ag | 硫酸铜溶液 |
D | Cu | Zn | 稀硫酸 |
A.AB.BC.CD.D