题目内容
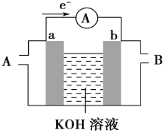
【题目】碱性联氨燃料电池具有能量密度较高和无污染等特点,其工作原理如下图所示,下列说法不正确的是

A.负极反应:N2H4-4e-=4H++N2↑
B.通入氧气的电极为正极
C.电池工作时OH-向负极移动
D.该电池工作一段时间后,电解质溶液碱性不变(不考虑电解质溶液的体积变化)
【答案】A
【解析】
A. 根据图示,负极N2H4失电子生成氮气和水,负极反应:N2H4-4e-+4OH-=4H2O+N2↑,故A错误;
B. 根据图示,Na+从左向右移动,右侧为正极,所以通入氧气的电极为正极,故B正确;
C. 原电池中阴离子移向负极,电池工作时OH-向负极移动,故C正确;
D. 根据电池总反应N2H4+O2=2H2O+N2↑,该电池工作一段时间后,电解质溶液碱性不变(不考虑电解质溶液的体积变化),故D正确;
选A;

【题目】化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。下列实验装置与实验目的对应的是( )
|
|
|
|
A用海水制蒸馏水 | B将碘水中的碘单质与水直接分离 | C除去Fe(OH)3胶体中的FeCl3 | D稀释浓硫酸 |
A.AB.BC.CD.D
【题目】亚硝酸氯(ClNO)是有机合成中的重要试剂。亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K1
2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K2
NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g)![]() 2ClNO(g) K3
2ClNO(g) K3
则K1、K2、K3之间的关系为K3=____________。
(2)T℃时,2NO(g)+Cl2(g)![]() 2ClNO(g)的正反应速率表达式为υ正=kcn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为υ正=kcn(ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/mol·L-1 | υ/mol·L-1· s-1 |
① | 0.30 | 3.6×10-8 |
② | 0.60 | 1.44×10-7 |
③ | 0.90 | 3.24×10-7 |
n=__________;k=___________(注明单位)。
(3)在2 L的恒容密闭容器中充入4 mol NO(g)和2molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图I。

① 温度为T1时,能作为该反应达到平衡的标志的有__________。
a.气体体积保持不变 b.容器压强保持不变 c.平衡常数K保持不变
d.气体颜色保持不变 e.υ(ClNO)=υ(NO) f.NO与ClNO的物质的量比值保持不变
② 反应开始到10min时,Cl2的平均反应速率υ(Cl2)=_______________。
③ 温度为T2时,10 min时反应已经达到平衡,该反应的平衡常数K=____________。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ随![]() 的变化如图II,则A、B、C三个状态中,NO的转化率最小的是____点,当
的变化如图II,则A、B、C三个状态中,NO的转化率最小的是____点,当![]() 时,达到平衡状态时ClNO的体积分数φ可能是D、E、F三点中的_____点。
时,达到平衡状态时ClNO的体积分数φ可能是D、E、F三点中的_____点。