题目内容
18.信息时代产生的大量电子垃圾对环境构成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: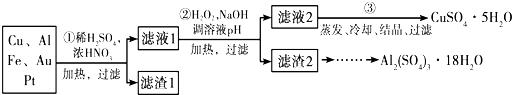
请回答下列问题:
(1)工业上冶铁的主要方法为热还原法.
(2)第②步加H2O2的作用是将Fe2+氧化为Fe3+,使用H2O2的优点是不引入杂质,对环境无污染;
(3)调溶液pH的目的是使Fe3+、Al3+生成沉淀.
(4)由滤渣2制取Al2(SO4)3•18H2O,探究小组设计了三种方案:

上述三种方案中,甲方案不可行,原因是甲方案得到的硫酸铝晶体中混有大量硫酸铁杂质.
分析 (1)工业上主要用热还原法来炼铁;
(2)第②步加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染;
(3)调溶液PH的目的是使Fe3+和Al3+形成沉淀;
(4)依据实验方案过程分析制备晶体中是否含有杂质,使用的试剂作用,原料的利用率,原子利用率因素分析判断;
解答 解:(1)工业上主要用热还原法来炼铁,故答案为:热还原法;
(2)第②步加H2O2的作用是将Fe2+氧化为Fe3+:2Fe2++H2O2+2H+=2Fe3++2H2O,过氧化氢做氧化剂被还原后为水,不引入杂质,对环境无污染,故答案为:将Fe2+氧化为Fe3+;不引入杂质,对环境无污染;
(3)调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,
故答案为:Fe3+、Al3+;
(4)制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,故不合理,故答案为:甲方案得到的硫酸铝晶体中混有大量硫酸铁杂质;
点评 本题考查制备硫酸铜和硫酸铝晶体的实验设计,明确离子的性质是解答本题关键,题目难度中等.

练习册系列答案
相关题目
8.下列物质属于同系物的一组是( )
| A. | CH4与C2H4 | B. | C2H6与C3H8 | ||
| C. | 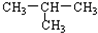 与CH3-CH2-CH2-CH3 与CH3-CH2-CH2-CH3 | D. | O2与O3 |
6.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1NA | |
| B. | 10g46%的乙醇水溶液中所含氢原子数目为0.06NA | |
| C. | 1L1 mol•L-1的NH4NO3溶液中含有NH4+数目为NA | |
| D. | 25℃时,100mlpH=13的Ba(OH)2溶液中OH-的数目为0.01NA |
13.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 1.7g H2O2中含有的电子数为0.9 NA | |
| B. | 等物质的量的N2和CO所含分子数均为NA | |
| C. | 1mol Na2O2 固体中含离子总数为4 NA | |
| D. | 标准状况下,2.24L戊烷所含分子数为0.1 NA |
10.将BaO2放入密闭的真空容器中,反应2BaO2(s)═2BaO(s)+O2(g)达到平衡.保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
| A. | 平衡常数减小 | B. | O2浓度增加 | C. | O2压强不变 | D. | BaO量不变 |
8.在温度,容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:[已知2CO(g)+O2(g)?2CO2(g)△H=-566.0KJ/mol-1]
下列关系不正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol CO、1mol O2 | 2mol CO2 | 4mol CO2 |
| CO2的浓度(mol•L-1) | C1 | C2 | C3 |
| 反应的能量变化 | 放出aKJ | 吸收bKJ | 吸收CkJ |
| 体系压强(Pa) | P1 | P2 | P3 |
| A. | 2c1<c3 | B. | a+b=283.0 | C. | 2p2>p3 | D. | c1=c2 |